化学反应的可逆性 知识点题库
压强(MPa) 氨的含量 温度(℃) | 0.1 | 10 | 30 | 60 | 100 |
200 | 0.153 | 0.815 | 0.899 | 0.954 | 0.988 |
300 | 0.022 | 0.520 | 0.710 | 0.842 | 0.926 |
400 | 0.004 | 0.251 | 0.470 | 0.652 | 0.798 |
(1)200℃、100MPa时,平衡混合物中氨的含量已达0.988,如果继续增大压强
(填“能”或“不能”)使平衡混合物中氨的含量等于1,理由是:
(2)欲使平衡混合物中氨的含量增大,则可采取的措施有:
(3)欲使平衡混合物中氨的含量为0.710,则选择的反应条件应为:
 2SO3(g)在某一密闭容器中进行,某一时刻测得c(SO2)=0.2mol/L c(O2)=0.15mol/L c(SO3)=0.2mol/L,反应一段时间,下列可能的是( )
2SO3(g)在某一密闭容器中进行,某一时刻测得c(SO2)=0.2mol/L c(O2)=0.15mol/L c(SO3)=0.2mol/L,反应一段时间,下列可能的是( )
 2H2↑+O2↑,2H2+O2
2H2↑+O2↑,2H2+O2  2H2O
B . NH3+CO2+H2O═NH4HCO3 , NH4HCO3
2H2O
B . NH3+CO2+H2O═NH4HCO3 , NH4HCO3  NH3↑+H2O↑+CO2↑
C . H2+I2
NH3↑+H2O↑+CO2↑
C . H2+I2  2HI,2HI
2HI,2HI  H2↑+I2↑
D . 2Ag+Br2
H2↑+I2↑
D . 2Ag+Br2  2AgBr,2AgBr
2AgBr,2AgBr  2Ag+Br2
2Ag+Br2
 CO2(g)+H2(g) △H=-41kJ·mol-1 , 下列判断正确的是( )
CO2(g)+H2(g) △H=-41kJ·mol-1 , 下列判断正确的是( )
 2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是( )
2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是( )
(ⅰ)I2(?)+H2(g)  2HI(g)+9.48 kJ (ⅱ)I2(?)+H2(g)
2HI(g)+9.48 kJ (ⅱ)I2(?)+H2(g)  2HI(g)-26.48 kJ
2HI(g)-26.48 kJ
| 选项 | 实验操作 | 实验现象 | 解释或结论 |
| A | 常温下,测 | pH: | 金属性: |
| B | 常温下,用pH计分别测定等体积1 | 测得pH都等于7 | 同温下,不同浓度的 |
| C | 将带火星的木条伸入到盛有硝酸铜固体分解产生的混合气体中 | 带火星的木条复燃 | |
| D | 向5mL0.1mol/L | 溶液变红 | KI与 |
 )含有2NA个As-As键
D . 标准状况下,1.12L氮气含有的电子数为0.2NA
)含有2NA个As-As键
D . 标准状况下,1.12L氮气含有的电子数为0.2NA
 2H2↑+O2↑;②高温使水分解制氢:2H2O
2H2↑+O2↑;②高温使水分解制氢:2H2O 2H2↑+O2↑;③太阳能催化分解水制氢:2H2O
2H2↑+O2↑;③太阳能催化分解水制氢:2H2O 2H2↑+O2↑;④天然气氧:CH4+H2O
2H2↑+O2↑;④天然气氧:CH4+H2O CO+3H2。
CO+3H2。
-
(1) 你认为最节能的方法是(填序号)。
-
(2) 反应①和氢气在氧气中燃烧生成水的反应是否互为可逆反应?(选填“是”或“否”)。
-
(3) 请依据表中常见物质的键能(在25℃,101kPa下)回答问题:
化学键
H—H
H—O
I—I
H—I
O=O
键能kJ·mol-1
435
460
150
300
500
①由氢气与氧气生成18g水放出的热量为kJ。
②若将1molI2和1molH2置于密闭容器中,并在上述条件下反应,发现热量实测值(恢复到25℃,101kPa)远小于15kJ,你认为最可能的原因是。
【查阅资料】a.Fe3+能将I-氧化为I2 , 所得溶液呈黄色或棕黄色。
b.利用色度计可测定溶液的透光率,通常溶液颜色越深,透光率数值越小。
【实验过程】

用图1所示装置进行如表所示的3个实验。
序号 | 实验步骤1 | 实验步骤2 |
实验I | 将盛有2mL蒸馏水的比色皿放入色度计的槽孔中 | 向比色皿中逐滴滴入5滴(每滴约0.025mL)0.1mol·L-1FeCl3溶液,同时采集上述过程中溶液的透光率数据 |
实验II | 将盛有2mL0.05mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
实验III | 将盛有a mL0.1mol·L-1KI溶液的比色皿放入色度计的槽孔中 | 同上 |
实验数据:

【分析与解释】
-
(1) 实验I的目的是。
-
(2) 实验III中a=。
-
(3) 通过上述实验可推断:FeCl3溶液与KI溶液的反应存在限度。其证据及相应的推理过程是。
-
(4) FeCl3溶液与KI溶液反应的离子方程式为。
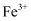 能与
能与 反应生成
反应生成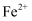 和
和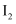 , 取10mL0.1mol/LKI溶液,滴加0.1mol/L
, 取10mL0.1mol/LKI溶液,滴加0.1mol/L 溶液3~4滴,充分反应后,继续加入2mL
溶液3~4滴,充分反应后,继续加入2mL 振荡,静置,下列有关该实验的说法正确的是( )
振荡,静置,下列有关该实验的说法正确的是( )
 层溶液呈紫红色
B . 取少量上层溶液,滴加
层溶液呈紫红色
B . 取少量上层溶液,滴加 溶液,只有白色沉淀生成
C . 该实验中KI与
溶液,只有白色沉淀生成
C . 该实验中KI与 反应后(未加
反应后(未加 ),溶液中只存在
),溶液中只存在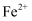 、
、 、
、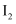 微粒
D . 取少量上层溶液,滴加KSCN溶液,若溶液显红色,则表明该反应存在化学反应限度
微粒
D . 取少量上层溶液,滴加KSCN溶液,若溶液显红色,则表明该反应存在化学反应限度
-
(1) 某同学在实验室中,欲用下图装置制备并收集一瓶干燥的氨气。

①实验室利用
 和
和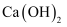 制备氨气的化学方程式为;
制备氨气的化学方程式为;②欲用上述方法收集一瓶干燥的氨气,装置连接顺序为a→;
-
(2) 工业合成氨的反应
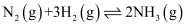 是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂1mol相应化学键需要的能量如下:
是一个可逆反应,反应条件是高温、高压,并且需要合适的催化剂。已知断裂1mol相应化学键需要的能量如下:化学键
H-H
N-H
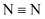
能量
436kJ
391kJ
946kJ
若反应生成
 , 可(填“吸收”或“放出”)热量kJ;
, 可(填“吸收”或“放出”)热量kJ; -
(3) 电化学气敏传感器可用于监测环境中
 的含量,其工作原理如图。
的含量,其工作原理如图。
①离子导体中,
 向Pt电极(填“a”或“b”)移动;
向Pt电极(填“a”或“b”)移动;②写出Pt电极(b)上的电极反应式:。
-
(1) 写出实验室制取氨气的化学方程式为。
-
(2) 将NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好),烧杯Z中盛装NaOH溶液(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O),在一定温度下按如图装置进行实验。

①打开K1 , 推动注射器活塞,使X中的气体缓慢通入Y管中,红棕色气体慢慢变浅。发生反应的化学方程式为。
②将注射器活塞退回原处并固定,待装置恢复到室温。打开K2 , Z中NaOH溶液产生倒吸现象,原因是。
-
(3) 利用(2)中装置探究SO2能否与Na2O2发生氧化还原反应。将Y中的药品更换为少量Na2O2 , 将注射器X中SO2缓慢推入Y中,Y装置中的现象为。
-
(4) 100℃时,在2L密闭容器中发生反应N2O4(g)
 2NO2(g),各气体浓度随时间变化的情况如图所示。
2NO2(g),各气体浓度随时间变化的情况如图所示。
①当N2O4的浓度为0.06mol·L-1'时,反应时间为ts,则0~ts时,用NO2气体的浓度变化量表达该反应的平均速率为。
②已知NO2(g)与SO2(g)发生可逆反应:NO2(g)+SO2(g)
 SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是。
SO3(g)+NO(g)(该反应正向为放热反应)。在一定条件下,向1L密闭容器中充入4molNO2(g)和2molSO2(g)充分反应,下列说法正确的是。a.只要经过足够长的时间,可使c(SO2)=0
b.每消耗1molSO2 , 同时生成1molNO2 , 说明该反应达到平衡状态
c.达到平衡状态时,各物质的物质的量浓度相等
d.当气体颜色不再变化时,若升高温度,气体的颜色会发生变化
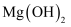 饱和溶液与
饱和溶液与 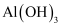 饱和溶液的pH
饱和溶液的pH


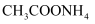 溶液和0.1
溶液和0.1  能支持木条燃烧
能支持木条燃烧 溶液中滴加3mL0.1mol/LKI溶液,充分反应后,取少量反应后溶液于试管中,再滴入几滴KSCN溶液
溶液中滴加3mL0.1mol/LKI溶液,充分反应后,取少量反应后溶液于试管中,再滴入几滴KSCN溶液


