焓变和熵变 知识点题库
-
(1) Ⅰ.工业上可利用CO2来制备清洁燃料甲醇,有关化学反应如下:
反应A:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1
CH3OH(g)+H2O(g) △H1=-49.6kJ·mol-1反应B:CO2(g)+H2
 H2O(g)+CO(g) △H2=+41kJ·mol-1
H2O(g)+CO(g) △H2=+41kJ·mol-1写出用CO(g)和H2(g)合成CH3OH(g)反应的热化学方程式:。
-
(2) 反应A可自发进行的温度条件是(填“低温”或“高温”)。
-
(3) 写出两个有利于提高反应A中甲醇平衡产率的条件。
-
(4) 在Cu-ZnO/ZrO2催化下,CO2和H2混和气体,体积比1∶3,总物质的量amol进行反应,测得CO2转化率、CH3OH和CO选择性随温度、压强变化情况分别如图所示(选择性:转化的CO2中生成CH3OH或CO的百分比)。

①由上图可知,影响产物选择性的外界条件是。
A.温度 B.压强 C.催化剂
②图1中M点温度为250℃,CO2的平衡转化率为25%,该温度下反应B的平衡常数为(用分数表示)。
-
(5) Ⅱ.实验室模拟“间接电化学氧化法”处理氨氮废水中NH4+的装置如图所示。以硫酸铵和去离子水配制成初始的模拟废水,并以NaCl调节溶液中氯离子浓度,阳极产物将氨氮废水中的NH4+氧化成空气中的主要成分。

阳极反应式为。
-
(6) 除去NH4+的离子反应方程式为。
 N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下:
N2(g)+2CO2(g)。一定温度下,在三个体积均为1.0L恒容密闭容器中发生上述反应,测得有关实验数据如下: | 容器 | 温度/(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | ||||
| NO | CO | N2 | CO2 | N2 | CO2 | ||
| I | 400 | 0.2 | 0.2 | 0 | 0 | 0.12 | |
| II | 400 | 0.4 | 0.4 | 0 | 0 | ||
| III | 300 | 0 | 0 | 0.1 | 0.2 | 0.075 | |
下列说法正确的是( )
-
(1) 关于反应H2(g)+1/2O2(g)=H2O(l),下列说法错误的是________。A . 焓变ΔH<0,熵变ΔS<0 B . 可以把反应设计成原电池,实现能量的转化 C . 一定条件下,若观察不到水的生成,说明该条件下反应不能自发进行 D . 选用合适的催化剂,有可能使反应在常温常压下以较快的速率进行
-
(2) ①根据H2O的成键特点,画出与图中H2O分子直接相连的所有氢键(O-H…O)。
②将一定量水放入抽空的恒容密闭容器中,测定不同温度(T)下气态、液态水平衡共存[H2O(l)H2O(g)]时的压强(p)。在图中画出从20℃开始经过100℃的p随T变化关系示意图(20℃时的平衡压强用p1表示)。


-
(3) 水在高温高压状态下呈现许多特殊的性质。当温度、压强分别超过临界温度(374.2℃)、临界压强(22.1 MPa)时的水称为超临界水。
①与常温常压的水相比,高温高压液态水的离子积会显著增大。解释其原因。
②如果水的离子积Kw从1.0×10−14增大到1.0×10−10 , 则相应的电离度是原来的倍。
③超临界水能够与氧气等氧化剂以任意比例互溶,由此发展了超临界水氧化技术。一定实验条件下,测得乙醇的超临界水氧化结果如图所示,其中x为以碳元素计的物质的量分数,t为反应时间。


下列说法合理的是。
A.乙醇的超临界水氧化过程中,一氧化碳是中间产物,二氧化碳是最终产物
B.在550℃条件下,反应时间大于15 s时,乙醇氧化为二氧化碳已趋于完全
C.乙醇的超临界水氧化过程中,乙醇的消耗速率或二氧化碳的生成速率都可以用来表示反应的速率,而且两者数值相等
D.随温度升高,xCO峰值出现的时间提前,且峰值更高,说明乙醇的氧化速率比一氧化碳氧化速率的增长幅度更大
-
(4) 以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8 , 再与水反应得到H2O2 , 其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是。
②制备H2O2的总反应方程式是。

 N2(g)+CO2(g)+2H2O(g),在10L密闭容器中分别加入0.50molCH4和1.2molNO2 , 测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:下列说法正确的是( )
N2(g)+CO2(g)+2H2O(g),在10L密闭容器中分别加入0.50molCH4和1.2molNO2 , 测得不同温度下n(CH4)随时间变化的有关实验数据如表所示:下列说法正确的是( ) | 组别 | 温度/K | 物质的量/mol 时间/min | 0 | 10 | 20 | 40 | 50 |
| ① | T1 | n(CH4) | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
| ② | T2 | n(CH4) | 0.50 | 0.30 | 0.18 | M | 0.15 |
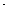 L−1
L−1 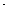 min−1
B . 由实验数据可知温度T1>T2
C . 40min时,表格中M对应的数据为0.15
D . 该反应在高温下不能自发进行
min−1
B . 由实验数据可知温度T1>T2
C . 40min时,表格中M对应的数据为0.15
D . 该反应在高温下不能自发进行

-
(1) 表示滴定盐酸的曲线是。(填I或II)
-
(2) 当醋酸中滴入10 mL NaOH溶液时,溶液中含有的溶质有:;溶液中离子浓度由大到小顺序为:。
-
(3) 当醋酸中滴入20 mL NaOH溶液时,将所得溶液加热,溶液pH随温度变化如图所示。下列说法正确的是。(填序号)
a. 加热促进水的电离和醋酸钠水解
b. 加热使溶液碱性减弱
c. 加热使溶液中c(H+)/c(OH-)比值减小

-
(1) 区分Al2O3-C耐火材料和钢的简易方法是。
-
(2) 在埋炭实验条件下,不同碳素材料的Al2O3-C耐火材料与铁液之间的可能反应如下:
①2Al2O3(s)
 4Al(s)+3O2(g) △H1= +3351.4 kJ·mol - 1
4Al(s)+3O2(g) △H1= +3351.4 kJ·mol - 1②C(s)+O2(g)=CO2(g) △H2= -393.5 kJ·mol - 1
③C(s)+CO2(g)=2CO(g) △H3=+172.5 kJ·mol - 1
④3C(s)+Al2O3(s)
 2Al(s)+3CO(g) △H4
2Al(s)+3CO(g) △H4则△H4= kJ·mol- 1。
-
(3) 直接碳热还原氧化铝法除需要高温外,系统中生成的碳化铝、碳氧化铝等会与生成的铝混合在一起,难以分离。实际生产中,至今仍未用直接碳热还原氧化铝法来炼铝。氧化铝碳热还原氯化法炼铝是生产铝的一种可行性新方法,其反应过程如下:
⑤Al2O3(s) +3C(s)+ AlCl3(g)
 3AlCl(g)+ 3CO(g) △H5
3AlCl(g)+ 3CO(g) △H5⑥3AlCl(g)
 2Al(l)+AlCl3(g) △H6
2Al(l)+AlCl3(g) △H6反应⑤、反应⑥中吉布斯自由能(△G)与温度(T)的变化关系如图1所示,由此判断反应⑤对应图中的曲线(填“I”或“II”),试分析氧化铝碳热还原氯化法炼铝的可行性:。
-
(4) 在埋炭情况下,碳过剩时,碳的氧化反应主要考虑:C(s)+CO2(g)
 2CO(g)。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 mol CO2(g),平衡时体系中气体体积分数与温度的关系如图2所示。
2CO(g)。在实验室研究该反应,一定温度下,向某体积可变的恒压密闭容器(总压强为p总)中加入足量的碳和2 mol CO2(g),平衡时体系中气体体积分数与温度的关系如图2所示。 
①650℃反应达到平衡时,容器体积为10 L,则平衡时c(CO)=。
②T℃时,若向平衡体系中再充入一定量n(CO):n(CO2)=2:3的混合气体,则平衡(填“向正反应方向”、“向逆反应方向”或“不”)移动。
③800℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp= [用含p总的代数式表示,气体分压(p分)=气体总压(p总)×体积分数]。
-
(5) CO可作某熔融盐电池的燃料,电解质为Li2CO3和Na2CO3的熔融盐混合物,空气与CO2的混合气为助燃气,电池在650℃下工作时,负极的电极反应式为。
 与
与 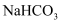 共1mol的溶液中,
共1mol的溶液中,  B . 25℃时,
B . 25℃时,  溶液的
溶液的  大于
大于  溶液的
溶液的  C .
C .  受热分解为
受热分解为  和
和  ,
,  D . 误将钡盐
D . 误将钡盐  当作食盐食用后,常用0.5%的
当作食盐食用后,常用0.5%的  溶液解毒
溶液解毒

下列说法错误的是( )
 和
和  混合,在一定条件下反应合成尿素:
混合,在一定条件下反应合成尿素:  ,下列有关该反应的说法正确的是( )
,下列有关该反应的说法正确的是( )
 B . 反应的平衡常数
B . 反应的平衡常数  C . 反应每生成
C . 反应每生成  需消耗
需消耗  D . 用E表示键能,该反应
D . 用E表示键能,该反应 
 ,
,  B . 化学反应中的能量变化都是以热能形式表现出来的
C .
B . 化学反应中的能量变化都是以热能形式表现出来的
C . 
 , 则正丁烷比异丁烷稳定
D . 等质量的固态硫与气态硫完全燃烧的反应热(△H),前者小于后者
, 则正丁烷比异丁烷稳定
D . 等质量的固态硫与气态硫完全燃烧的反应热(△H),前者小于后者



