焓变和熵变 知识点题库
CO(g)+2H2(g)⇌CH3OH(g)
①该反应的△H 0,△s 0(填“>”、“<”或“=”)
②若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度
B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大
D.再充人1molCO和3mol H2 .
-
(1) I.CO还原NO的脱硝反应:

已知:



脱硝反应△H=,该反应向正反应方向自发进行的倾向很大,其原因是,有利于提高NO平衡转化率的条件是(写出两条)。
-
(2) 以Mn3O4为脱硝反应的催化剂,研究者提出如下反应历程,将历程补充完整。
第一步:;
第二步:3MnO2+2CO=Mn3O4+2CO2
-
(3) 在恒温恒容的密闭容器中,充入等物质的量的CO和NO混合气体,加入Mn3O4发生脱硝反应,t0时达到平衡,测得反应过程中CO2的体积分数与时间的关系如右图所示。
①比较大小:a处V正b处V逆(填“>”、“<”或“=”)
②NO的平衡转化率为。

-
(4) II.T℃时,在刚性反应器中发生如下反应:
 ,化学反应速率
,化学反应速率  k为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示:
k为化学反应速率常数。研究表明,该温度下反应物的分压与化学反应速率的关系如下表所示: 
若反应初始时P(CO)=P(NO2)=akPa,反应t min时达到平衡,测得体系中P(NO)=bkPa,则此时v=
 (用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=(Kp是以分压表示的平衡常数)。
(用含有a和b的代数式表示,下同),该反应的化学平衡常数Kp=(Kp是以分压表示的平衡常数)。
-
(1) 已知:CO2(g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ•mol-1 CO(g)+H2O(g)
 CO2(g)+H2(g) ΔH3=-41.1kJ•mol-1
CO2(g)+H2(g) ΔH3=-41.1kJ•mol-1H2还原 CO反应合成甲醇的热化学方程式为:CO(g)+2H2(g)
 CH3OH(g) ΔH1 , 则ΔH1=kJ•mol-1 , 该反应自发进行的条件为
CH3OH(g) ΔH1 , 则ΔH1=kJ•mol-1 , 该反应自发进行的条件为A.高温
B.低温
C.任何温度条件下
-
(2) 恒温恒压下,在容积可变的密闭容器中加入 1molCO和2.2mol H2 , 发生反应CO(g)+2H2(g)
 CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1P2 , 判断的理由是。
CH3OH(g),实验测得平衡时CO的转化率随温度、压强的变化如图所示。则P1P2 , 判断的理由是。 
-
(3) 若反应 CO(g)+2H2(g)
 CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示:
CH3OH(g)在温度不变且体积恒定为1的密闭容器中发生,反应过程中各物质的物质的量随时间变化如表所示: 时间/min
0
5
10
15
H2
4
2
CO
2
1
CH3OH(g)
0
0.7
①下列各项能作为判断该反应达到平衡标志的是(填字母);
A.容器内压强保持不变
B.2v正(H2)=v逆(CH3OH)
C.混合气体的相对分子质量保持不变
D.混合气体的密度保持不变
②若起始压强为P0 kPa,则在该温度下反应的平衡常数Kp=(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
③反应速率若用单位时间内分压的变化表示,则10min内H2的反应速率v(H2)=kPa•min-1。
 N2O4(l)=
N2O4(l)= 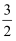 N2 (g)+2H2O(l) △H= -546.45 kJ▪mol-1
B . Mg2Ni(s)+2H2(g)= Mg2NiH4(s) △H= -64.4 kJ▪mol-1
C . CH4(g)+H2O(g)
N2 (g)+2H2O(l) △H= -546.45 kJ▪mol-1
B . Mg2Ni(s)+2H2(g)= Mg2NiH4(s) △H= -64.4 kJ▪mol-1
C . CH4(g)+H2O(g)  CO(g)+3H2(g) △H= +206.4 kJ▪mol-1
D . 2N2(g)+O2(g)= 2N2O(g) △H= +163 kJ▪mol-1
CO(g)+3H2(g) △H= +206.4 kJ▪mol-1
D . 2N2(g)+O2(g)= 2N2O(g) △H= +163 kJ▪mol-1
①CO(g)+2H2(g)  CH3OH(g) ΔH1=-90.1kJ·mol-1
CH3OH(g) ΔH1=-90.1kJ·mol-1
②CO2(g)+3H2(g)  CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1
CH3OH(g)+H2O(g) ΔH2=-49.0kJ·mol-1
③CO2(g)+H2(g)  CO(g)+H2O(g) ΔH3=+41.1kJ·mol-1
CO(g)+H2O(g) ΔH3=+41.1kJ·mol-1
④2CH3OH(g)  CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1。试回答下列问题:
CH3OCH3(g)+H2O(g) ΔH4=-24.5kJ·mol-1。试回答下列问题:
-
(1) 由H2和CO直接制备二甲醚的热化学方程式:2CO(g)+4H2(g)
 CH3OCH3(g)+H2O(g) ΔH =kJ·mol-1;该反应可以自发进行的条件为。
CH3OCH3(g)+H2O(g) ΔH =kJ·mol-1;该反应可以自发进行的条件为。
-
(2) 将1.0mol CO2 和 3.0mol H2 充入2L恒容密闭容器中,使其仅按反应②进行,在不同催化剂作用下,相同时间内 CO2 的转化率随温度变化如图所示。下列说法正确的是______________A . T3对应的平衡常数小于T4对应的平衡常数 B . 根据图中曲线分析,催化剂I的催化效果最好 C . b点v(正)可能等于v(逆) D . a点的转化率比c点高可能的原因是该反应为放热反应,升温平衡逆向移动,转化率降低
-
(3) 若CO2和H2仅发生反应②和③,研究表明:在其他条件相同的情况下,用新型催化剂可以显著提高甲醇的选择性,使用该催化剂,按 n(CO2):n(H2)=1:3(总量为a mol)投料于恒容密闭容器中进行反应,CO2的平衡转化率和甲醇的选择率(甲醇的选择率:转化的 CO2中生成甲醇的物质的量分数)随温度的变化趋势如图所示:(忽略温度对催化剂的影响)
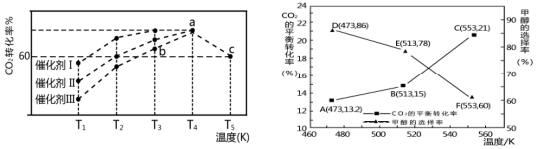
①在553K达到平衡时,反应体系内甲醇的物质的量为mol。
②随着温度的升高,CO2的平衡转化率增加但甲醇的选择率降低,请分析其原因: 。
-
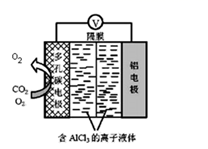
(4) O2催化辅助的 Al-CO2电池工作原理如图所示。该电池电容量大,能有效利用CO2 , 电池反应产物Al2(C2O4)3是重要的化工原料。 则电池的正极反应式:6O2+6e-=6O2-和 。
-
(1) Ⅰ.在特定环境中有效地处理CO2具有重要的研究价值。CO2的转化途径之一为:
CO2 (g)+3H2(g)
 CH3OH(g)+H2O(g) ΔH<0
CH3OH(g)+H2O(g) ΔH<0请回答:
上述反应自发进行的条件为(“高温”“任意温度”或“低温”)。
-
(2) 某实验小组对该反应进行了如下探究:向Ⅰ、Ⅱ、Ⅲ三个容积均为2 L的相同的恒容密闭容器中分别投入1mol CO2、3 mol H2 , 同时在Ⅰ、Ⅱ、Ⅲ三个容器中分别加入等量的催化剂A、催化剂B和催化剂C,控制反应的温度,让其发生反应。测定在相同时间内CO2的转化率随温度的变化曲线如图所示:

①催化剂对反应的催化效果由强到弱的顺序为>> (选填A、B、C序号);
②b点时v (正)v(逆) (填“>”“<””或“=”);
③图中a、c点均表示反应已经达平衡状态,a点CO2的平衡转化率比c点高的原因是;
④T4 K时,此反应的平衡常数K=(结果保留两位小数)。
Ⅱ.甲醇可以通过MTP工艺制丙烯:
该工艺的主反应为:3CH3OH(g)
 C3H6(g)+3H2O(g) ΔH=-98.1 kJ·mol-1.此外还存在多个副反应。已知:①主反应与副反应(消耗CH3OH)都为放热反应;
C3H6(g)+3H2O(g) ΔH=-98.1 kJ·mol-1.此外还存在多个副反应。已知:①主反应与副反应(消耗CH3OH)都为放热反应;②催化剂选择性最佳温度为460℃。
在2 L恒容密闭容器中,充入2 mol甲醇(g),控制反应温度始终为460℃,t1时刻反应恰好达到平衡,此时甲醇(g)的平衡转化率为75%,发生主反应的选择性为40%,请在下图中画出0~t2时刻丙烯浓度随时间的变化图象。

-
(1) 已知25℃、101kPa时,以下反应的热化学方程式为:
4Fe(s)+3O2(g)=2Fe2O3(s) △H1=-1644kJ•mol-1
2CO(g)+O2(g)=2CO2(g) △H2=-564kJ•mol-1
C(s)+O2(g)=CO2(g) △H3=-393kJ•mol-1
则Fe2O3(s)+3C(s)=2Fe(s)+3CO(g)的△H=kJ•mol-1。
-
(2) 已知反应NO(g)+O3(g)
 NO2(g)+O2(g) △H=-200.9kJ•mol-1在低温下自发进行,则该反应的熵变△S0(填“大于”或“小于”)。
NO2(g)+O2(g) △H=-200.9kJ•mol-1在低温下自发进行,则该反应的熵变△S0(填“大于”或“小于”)。
-
(3) Ⅱ.资料显示,在催化剂存在条件下,可分别用CO和CO2作碳源,均能与H2S反应产生羰基硫(COS),COS是一种粮食熏蒸剂,能防治某些害虫和真菌的危害。具体反应如下:
反应1:CO(g)+H2S(g)
 COS(g)+H2(g) △H=-11.3kJ•mol-1
COS(g)+H2(g) △H=-11.3kJ•mol-1反应2:CO2(g)+H2S(g)
 COS(g)+H2O(g)
COS(g)+H2O(g)研究表明,反应1分两步完成,具体过程如下:
①2H2S(g)
 S2(g)+2H2(g) △H1=+168.9kJ•mol-1
S2(g)+2H2(g) △H1=+168.9kJ•mol-1②2CO(g)+S2(g)
 2COS(g) △H2
2COS(g) △H2已知,决定COS生成速率的步骤为第一步,请在图1中画出反应1两步过程的能量变化图(标清每步反应的产物和状态)。

-
(4) 在恒压密闭容器中,投入等物质的量的反应物,分别发生反应1和反应2。图2中,曲线a(实线)表示反应1在不同温度下反应相同时间t时,COS的物质的量分数;曲线b(虛线)表示反应2在不同温度下达到平衡时COS的物质的量分数。根据图中信息回答下列问题:
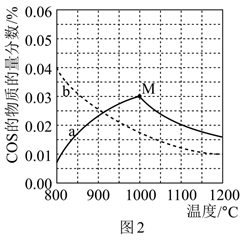
①由图2可知,反应2:CO2(g)+H2S(g)
 COS(g)+H2O(g)的△H0(填“>”或“<”),当温度升高时,反应2的化学平衡常数K(填“增大”、“减小”或“不变”),在a(绝热恒容)、b(恒温恒容)、c(恒温恒压)三个容器中,起始状态和投料等完全相同,如图3所示,反应达到平衡后,H2S的转化率由大到小的顺序为(用a、b、c表达)。
COS(g)+H2O(g)的△H0(填“>”或“<”),当温度升高时,反应2的化学平衡常数K(填“增大”、“减小”或“不变”),在a(绝热恒容)、b(恒温恒容)、c(恒温恒压)三个容器中,起始状态和投料等完全相同,如图3所示,反应达到平衡后,H2S的转化率由大到小的顺序为(用a、b、c表达)。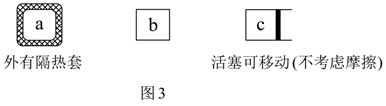
②图2中曲线a上,若M点反应1尚未达到平衡,则后面曲线变化的可能原因是;若M点反应1达到平衡,则请在图2中画出900℃~1100℃之间反应1平衡时COS的物质的量分数随温度的变化曲线。
| 选项 | 化学反应方程式 | 已知条件 | 预测 |
| A | M(s)=X(g)+Y(s) | ΔH>0 | 它是非自发反应 |
| B | W(s)+xG(g)=2Q(g) | ΔH<0,自发反应 | x可能等于1、2、3 |
| C | 4X(g+5Y(g)=4W(g)+6G(g) | 能自发反应 | ΔH一定小于0 |
| D | 4M(s)+N(g)+2W(l)=4Q(s) | 常温下,自发进行 | ΔH>0 |

下列关于活化历程的说法正确的是( )



