з„“еҸҳе’ҢзҶөеҸҳ зҹҘиҜҶзӮ№
зҶөеҸҳпјҡзү©иҙЁеңЁеҸҳеҢ–дёӯпјҢзҶөзҡ„еҸҳеҢ–йҮҸпјҢеҪ“ж°”дҪ“еҲҶеӯҗж•°еўһеӨҡж—¶пјҢж··д№ұеәҰеўһеӨ§пјҢз§°дёәзҶөеўһпјҢзҶөзҡ„еҸҳеҢ–йҮҸеӨ§дәҺйӣ¶гҖӮ
з„“еҸҳе’ҢзҶөеҸҳ зҹҘиҜҶзӮ№йўҳеә“
CO2пјҲgпјү+3H2пјҲgпјүв•җCH3OHпјҲlпјү+H2OпјҲlпјү
в‘ иҜҘеҸҚеә”иҮӘеҸ‘иҝӣиЎҢзҡ„жқЎд»¶жҳҜ пјҲеЎ«вҖңдҪҺжё©вҖқгҖҒвҖңй«ҳжё©вҖқжҲ–вҖңд»»ж„Ҹжё©еәҰвҖқпјү
в‘ЎдёӢеҲ—еҸҷиҝ°иғҪиҜҙжҳҺе®№еҷЁеҶ…еҸҚеә”иҫҫеҲ°е№іиЎЎзҠ¶жҖҒзҡ„жҳҜ
AпјҺж··еҗҲж°”дҪ“зҡ„е№іеқҮзӣёеҜ№еҲҶеӯҗиҙЁйҮҸдҝқжҢҒдёҚеҸҳ BпјҺCO2е’ҢH2зҡ„дҪ“з§ҜеҲҶж•°дҝқжҢҒдёҚеҸҳ
CпјҺCO2е’ҢH2зҡ„иҪ¬еҢ–зҺҮзӣёзӯү DпјҺж··еҗҲж°”дҪ“зҡ„еҜҶеәҰдҝқжҢҒдёҚеҸҳпјҺ
 CH3OH(g)пјӢH2O(g)пјҢеҰӮеӣҫиЎЁзӨәиҜҘеҸҚеә”иҝҮзЁӢдёӯиғҪйҮҸ(еҚ•дҪҚдёәkJВ·molпјҚ1)зҡ„еҸҳеҢ–гҖӮе…ідәҺиҜҘеҸҚеә”зҡ„дёӢеҲ—иҜҙжі•дёӯпјҢжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)
CH3OH(g)пјӢH2O(g)пјҢеҰӮеӣҫиЎЁзӨәиҜҘеҸҚеә”иҝҮзЁӢдёӯиғҪйҮҸ(еҚ•дҪҚдёәkJВ·molпјҚ1)зҡ„еҸҳеҢ–гҖӮе…ідәҺиҜҘеҸҚеә”зҡ„дёӢеҲ—иҜҙжі•дёӯпјҢжӯЈзЎ®зҡ„жҳҜ(гҖҖгҖҖ)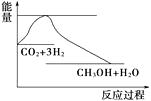
в‘ еҸҚеә”NH3(g)пјӢHCl(g) в•җ NH4Cl(s)еңЁе®Өжё©дёӢеҸҜиҮӘеҸ‘иҝӣиЎҢпјҢеҲҷиҜҘеҸҚеә”зҡ„О”Hпјһ0
в‘ЎCaCO3(s) в•җ CaO(s)пјӢCO2(g)е®Өжё©дёӢдёҚиғҪиҮӘеҸ‘иҝӣиЎҢпјҢиҜҙжҳҺиҜҘеҸҚеә”зҡ„О”H<0
в‘ўдёҖе®ҡжё©еәҰдёӢпјҢеҸҚеә”MgCl2(l) в•җ Mg(l)пјӢCl2(g)зҡ„О”Hпјһ0гҖҒО”Sпјһ0
в‘Јеёёжё©дёӢпјҢеҸҚеә”C(s)пјӢCO2(g) в•җ 2CO(g)дёҚиғҪиҮӘеҸ‘иҝӣиЎҢпјҢеҲҷиҜҘеҸҚеә”зҡ„О”Hпјһ0
-
пјҲ1пјү дәҢж°§еҢ–зўіеҠ ж°ўеҲ¶з”ІйҶҮзҡ„жҖ»еҸҚеә”еҸҜиЎЁзӨәдёәпјҡ
 пјҢиҜҘеҸҚеә”дёҖиҲ¬и®ӨдёәйҖҡиҝҮеҰӮдёӢжӯҘйӘӨжқҘе®һзҺ°пјҡ
пјҢиҜҘеҸҚеә”дёҖиҲ¬и®ӨдёәйҖҡиҝҮеҰӮдёӢжӯҘйӘӨжқҘе®һзҺ°пјҡ iпјҺ

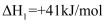
iiпјҺ

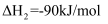
в‘ еҲҷжҖ»еҸҚеә”зҡ„
 kJ/molпјӣиҜҘеҸҚеә”еә”йҖүжӢ©й«ҳж•ҲеӮ¬еҢ–еүӮ(еЎ«вҖңй«ҳжё©вҖқжҲ–вҖңдҪҺжё©вҖқ)гҖӮ
kJ/molпјӣиҜҘеҸҚеә”еә”йҖүжӢ©й«ҳж•ҲеӮ¬еҢ–еүӮ(еЎ«вҖңй«ҳжё©вҖқжҲ–вҖңдҪҺжё©вҖқ)гҖӮв‘ЎдёҠиҝ°жҖ»еҸҚеә”еңЁе®№з§ҜдёҚеҸҳзҡ„еҜҶй—ӯе®№еҷЁиҝӣиЎҢпјҢеңЁ
 ж—¶иҫҫеҲ°е№іиЎЎпјҢеҪ“е…¶д»–жқЎд»¶дёҚеҸҳж—¶пјҢж”№еҸҳжҹҗдёҖжқЎд»¶пјҢе…ідәҺдёӢеҲ—еӣҫеғҸзҡ„жҸҸиҝ°пјҢиҜҙжі•й”ҷиҜҜзҡ„жҳҜгҖӮ
ж—¶иҫҫеҲ°е№іиЎЎпјҢеҪ“е…¶д»–жқЎд»¶дёҚеҸҳж—¶пјҢж”№еҸҳжҹҗдёҖжқЎд»¶пјҢе…ідәҺдёӢеҲ—еӣҫеғҸзҡ„жҸҸиҝ°пјҢиҜҙжі•й”ҷиҜҜзҡ„жҳҜгҖӮ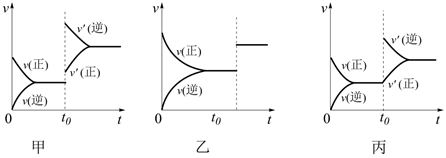
AпјҺеӣҫз”ІиЎЁзӨә
 ж—¶еҚҮй«ҳжё©еәҰеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ
ж—¶еҚҮй«ҳжё©еәҰеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“ҚBпјҺеӣҫд№ҷиЎЁзӨә
 ж—¶еҠ еҺӢжҲ–еӮ¬еҢ–еүӮеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ
ж—¶еҠ еҺӢжҲ–еӮ¬еҢ–еүӮеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“ҚCпјҺеӣҫдёҷиЎЁзӨә
 ж—¶еҲҶзҰ»еҮәз”ІйҶҮеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ
ж—¶еҲҶзҰ»еҮәз”ІйҶҮеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“ҚDпјҺеӣҫдёҷиЎЁзӨә
 ж—¶еўһеҠ ж°ҙи’ёж°”зҡ„зү©иҙЁзҡ„йҮҸеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ
ж—¶еўһеҠ ж°ҙи’ёж°”зҡ„зү©иҙЁзҡ„йҮҸеҜ№еҸҚеә”йҖҹзҺҮзҡ„еҪұе“Қ -
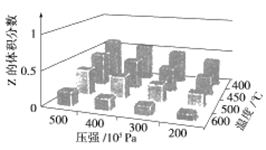
пјҲ2пјү иӢҘ
 в„ғж—¶е°Ҷ6mol
в„ғж—¶е°Ҷ6mol  е’Ң8mol
е’Ң8mol  е……е…Ҙ2LеҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹдёҠиҝ°еҗҲжҲҗжҖ»еҸҚеә”пјҢеҲқе§ӢеҺӢејәдёә
е……е…Ҙ2LеҜҶй—ӯе®№еҷЁдёӯеҸ‘з”ҹдёҠиҝ°еҗҲжҲҗжҖ»еҸҚеә”пјҢеҲқе§ӢеҺӢејәдёә  kPaпјҢжөӢеҫ—
kPaпјҢжөӢеҫ—  зҡ„зү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙеҸҳеҢ–еҰӮдёӢеӣҫ1дёӯзҠ¶жҖҒв… гҖӮеӣҫдёӯж•°жҚ®A(1пјҢ6)д»ЈиЎЁеңЁ1minж—¶
зҡ„зү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙеҸҳеҢ–еҰӮдёӢеӣҫ1дёӯзҠ¶жҖҒв… гҖӮеӣҫдёӯж•°жҚ®A(1пјҢ6)д»ЈиЎЁеңЁ1minж—¶  зҡ„зү©иҙЁзҡ„йҮҸжҳҜ6molгҖӮ
зҡ„зү©иҙЁзҡ„йҮҸжҳҜ6molгҖӮ в‘
 в„ғж—¶пјҢиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°
в„ғж—¶пјҢиҜҘеҸҚеә”зҡ„е№іиЎЎеёёж•°  (еҜ№дәҺж°”зӣёеҸҚеә”пјҢз”Ёжҹҗз»„еҲҶBзҡ„е№іиЎЎеҺӢејә
(еҜ№дәҺж°”зӣёеҸҚеә”пјҢз”Ёжҹҗз»„еҲҶBзҡ„е№іиЎЎеҺӢејә  д»Јжӣҝзү©иҙЁзҡ„йҮҸжө“еәҰ
д»Јжӣҝзү©иҙЁзҡ„йҮҸжө“еәҰ  д№ҹеҸҜиЎЁзӨәе№іиЎЎеёёж•°пјҢи®°дҪң
д№ҹеҸҜиЎЁзӨәе№іиЎЎеёёж•°пјҢи®°дҪң  пјҢеҰӮ
пјҢеҰӮ 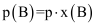 пјҢpдёәе№іиЎЎжҖ»еҺӢејәпјҢ
пјҢpдёәе№іиЎЎжҖ»еҺӢејәпјҢ 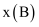 дёәе№іиЎЎдҪ“зі»дёӯBзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°)гҖӮ
дёәе№іиЎЎдҪ“зі»дёӯBзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°)гҖӮ
в‘Ўе…¶д»–жқЎд»¶дёҚеҸҳпјҢд»…ж”№еҸҳжҹҗдёҖжқЎд»¶еҗҺпјҢжөӢеҫ—
 зҡ„зү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙеҸҳеҢ–еҰӮеӣҫзҠ¶жҖҒIIгҖҒзҠ¶жҖҒIIIжүҖзӨәгҖӮеҲҷзҠ¶жҖҒIIIж”№еҸҳзҡ„жқЎд»¶еҸҜиғҪжҳҜгҖӮ
зҡ„зү©иҙЁзҡ„йҮҸйҡҸж—¶й—ҙеҸҳеҢ–еҰӮеӣҫзҠ¶жҖҒIIгҖҒзҠ¶жҖҒIIIжүҖзӨәгҖӮеҲҷзҠ¶жҖҒIIIж”№еҸҳзҡ„жқЎд»¶еҸҜиғҪжҳҜгҖӮв‘ўдёҠиҝ°еҸҚеә”(зҠ¶жҖҒI)иҫҫеҲ°е№іиЎЎеҗҺпјҢдҝқжҢҒе…¶д»–жқЎд»¶дёҚеҸҳпјҢеңЁ
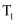 ж—¶еҲ»иҝ…йҖҹе°Ҷе®№еҷЁдҪ“з§ҜеҺӢзј©иҮі1LпјҢиҜ·еңЁеӣҫ2дёӯз”»еҮә
ж—¶еҲ»иҝ…йҖҹе°Ҷе®№еҷЁдҪ“з§ҜеҺӢзј©иҮі1LпјҢиҜ·еңЁеӣҫ2дёӯз”»еҮә 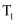 ж—¶еҲ»еҗҺ
ж—¶еҲ»еҗҺ  зҡ„еҸҳеҢ–и¶ӢеҠҝеӣҫгҖӮ
зҡ„еҸҳеҢ–и¶ӢеҠҝеӣҫгҖӮ -
пјҲ3пјү еҗҲжҲҗжҖ»еҸҚеә”еңЁиө·е§Ӣзү©
 ж—¶пјҢеңЁдёҚеҗҢжқЎд»¶дёӢиҫҫеҲ°е№іиЎЎпјҢи®ҫдҪ“зі»дёӯз”ІйҶҮзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°дёә
ж—¶пјҢеңЁдёҚеҗҢжқЎд»¶дёӢиҫҫеҲ°е№іиЎЎпјҢи®ҫдҪ“зі»дёӯз”ІйҶҮзҡ„зү©иҙЁзҡ„йҮҸеҲҶж•°дёә  пјҢеңЁt=250в„ғдёӢзҡ„
пјҢеңЁt=250в„ғдёӢзҡ„  еӣҫе’ҢеңЁ
еӣҫе’ҢеңЁ 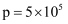 PaдёӢзҡ„
PaдёӢзҡ„  еӣҫеҰӮеӣҫ3жүҖзӨәпјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ
еӣҫеҰӮеӣҫ3жүҖзӨәпјҢиҜ·еӣһзӯ”дёӢеҲ—й—®йўҳпјҡ 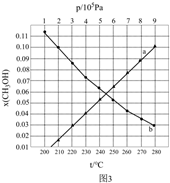
в‘ еӣҫдёӯеҜ№еә”зӯүеҺӢиҝҮзЁӢзҡ„жӣІзәҝжҳҜпјҢеҲӨж–ӯзҗҶз”ұжҳҜгҖӮ
в‘ЎеҪ“
 ж—¶пјҢ
ж—¶пјҢ  е№іиЎЎиҪ¬еҢ–зҺҮОұ=(дҝқз•ҷдёҖдҪҚе°Ҹж•°)гҖӮ
е№іиЎЎиҪ¬еҢ–зҺҮОұ=(дҝқз•ҷдёҖдҪҚе°Ҹж•°)гҖӮ
 пјҢ
пјҢ  C .
C . 
 пјҢ иҜҘеҸҚеә”иғҪеҗҰиҮӘеҸ‘иҝӣиЎҢдёҺжё©еәҰж— е…і
D . зЎқй…ёй“өжә¶дәҺж°ҙеҸҜиҮӘеҸ‘иҝӣиЎҢпјҢеӣ дёәиҜҘиҝҮзЁӢ
пјҢ иҜҘеҸҚеә”иғҪеҗҰиҮӘеҸ‘иҝӣиЎҢдёҺжё©еәҰж— е…і
D . зЎқй…ёй“өжә¶дәҺж°ҙеҸҜиҮӘеҸ‘иҝӣиЎҢпјҢеӣ дёәиҜҘиҝҮзЁӢ
 иҪҪж°®дҪ“зҡ„зўіеҹәеҢ–еӯҰй“ҫеҗҲжҲҗж°ЁжҠҖжңҜзӨәж„ҸеӣҫеҰӮдёӢгҖӮ
иҪҪж°®дҪ“зҡ„зўіеҹәеҢ–еӯҰй“ҫеҗҲжҲҗж°ЁжҠҖжңҜзӨәж„ҸеӣҫеҰӮдёӢгҖӮ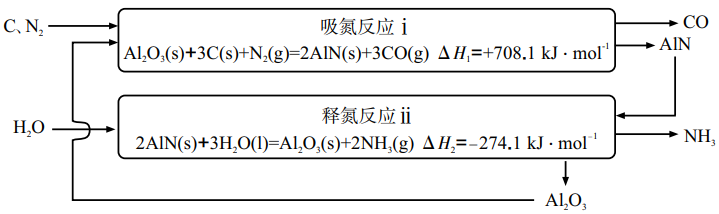
-
пјҲ1пјү жҖ»еҸҚеә”
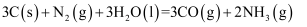
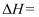
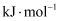 гҖӮ
гҖӮ
-
пјҲ2пјү жңүеҲ©дәҺжҸҗй«ҳеҸҚеә”в…°е№іиЎЎиҪ¬еҢ–зҺҮзҡ„жқЎд»¶дёә____(еЎ«ж ҮеҸ·)гҖӮA . й«ҳжё©й«ҳеҺӢ B . й«ҳжё©дҪҺеҺӢ C . дҪҺжё©й«ҳеҺӢ D . дҪҺжё©дҪҺеҺӢ
-
пјҲ3пјү еңЁжё©еәҰtгҖҒ100kPaжқЎд»¶дёӢиҝӣиЎҢеҸҚеә”в…°пјҢе№іиЎЎж—¶иӢҘж°®ж°”иҪ¬еҢ–зҺҮдёә50%пјҢеҲҷ
 еҺӢејәдёәпјҢе№іиЎЎеёёж•°
еҺӢејәдёәпјҢе№іиЎЎеёёж•°
 (д»ҘеҲҶеҺӢиЎЁзӨәпјҢеҲҶеҺӢ=жҖ»еҺӢГ—зү©иҙЁзҡ„йҮҸеҲҶж•°)гҖӮ
(д»ҘеҲҶеҺӢиЎЁзӨәпјҢеҲҶеҺӢ=жҖ»еҺӢГ—зү©иҙЁзҡ„йҮҸеҲҶж•°)гҖӮ
-
пјҲ4пјү 60в„ғгҖҒ100kPaжқЎд»¶дёӢпјҢеҸҚеә”в…°дёӯжә¶ж¶ІpHйҡҸж—¶й—ҙеҸҳеҢ–еҰӮеӣҫпјҢ120minпҪһ180minжҢҒз»ӯ收йӣҶеҲ°ж°Ёж°”пјҢдҪҶжә¶ж¶ІpHеҮ д№ҺдёҚеҸҳзҡ„еҺҹеӣ жҳҜгҖӮ
-
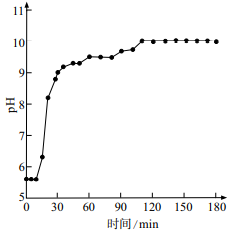
пјҲ5пјү дёәжҺўз©¶еҸҚеә”в…ұдёӯ15minж—¶еҸҚеә”йҖҹзҺҮзӘҒ然еҠ еҝ«зҡ„еҺҹеӣ пјҢжҲ‘еӣҪ科еӯҰ家еҲ©з”Ёи®Ўз®—жңәжЁЎжӢҹдәҶеҸҚеә”в…ұзҡ„еҸҚеә”и·Ҝеҫ„гҖӮ
в‘ жҜ”иҫғдёҚеҗҢи·Ҝеҫ„пјҢи·Ҝеҫ„1иғҪеһ’иҫғдҪҺзҡ„еҺҹеӣ жҳҜзҡ„й”®иғҪеӨ§дәҺзҡ„й”®иғҪгҖӮ
в‘Ў15minж—¶еҸҚеә”йҖҹзҺҮзӘҒ然еҠ еҝ«зҡ„еҺҹеӣ жҳҜгҖӮ
-
пјҲ6пјү зӣёиҫғдәҺе“ҲдјҜжі•еҗҲжҲҗж°ЁпјҢзўіеҹәеҢ–еӯҰй“ҫеҗҲжҲҗж°Ёзҡ„дјҳеҠҝжңүиғҪеӨҹйҷҚдҪҺиғҪиҖ—гҖҒеҮҸе°‘еҺҹж–ҷжҲҗжң¬гҖӮ(еҶҷеҮәдёҖжқЎеҚіеҸҜ)гҖӮ
N2(g)+3H2(g) 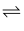 2NH3(g) О”H=-92.4kJВ·mol-1
2NH3(g) О”H=-92.4kJВ·mol-1
NaCl+NH3+CO2+H2O=NaHCO3вҶ“+NH4Cl
2NaHCO3  Na2CO3+CO2вҶ‘+H2O
Na2CO3+CO2вҶ‘+H2O
еҜ№дәҺеҸҚеә”N2(g)+3H2(g) 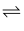 2NH3(g)пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
2NH3(g)пјҢдёӢеҲ—иҜҙжі•жӯЈзЎ®зҡ„жҳҜпјҲ пјү
 C . е…¶д»–жқЎд»¶зӣёеҗҢпјҢеўһеӨ§
C . е…¶д»–жқЎд»¶зӣёеҗҢпјҢеўһеӨ§ 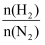 пјҢH2иҪ¬еҢ–зҺҮеҮҸе°Ҹ
D . дҪҝз”ЁеӮ¬еҢ–еүӮиғҪйҷҚдҪҺиҜҘеҸҚеә”зҡ„з„“еҸҳ
пјҢH2иҪ¬еҢ–зҺҮеҮҸе°Ҹ
D . дҪҝз”ЁеӮ¬еҢ–еүӮиғҪйҷҚдҪҺиҜҘеҸҚеә”зҡ„з„“еҸҳ
 SO3(1)+NO(g)пјҢиҜҘеҸҚеә”зҡ„ О”Sпјң0
B . 2CO(g)=2C(s) + O2(g) О”Hпјһ0пјҢ й«ҳжё©дёӢеҸҜд»ҘиҮӘеҸ‘
C . C(sпјҢйҮ‘еҲҡзҹі)=C(sпјҢзҹіеўЁ) О”H= -1.9 kJВ·mol-1 пјҢ йҮ‘еҲҡзҹіжҜ”зҹіеўЁжӣҙзЁіе®ҡ
D . йҖүжӢ©й«ҳж•ҲеӮ¬еҢ–еүӮеҸҜд»ҘйҷҚдҪҺеҸҚеә”зҡ„з„“еҸҳпјҢжҸҗй«ҳеҢ–еӯҰеҸҚеә”йҖҹзҺҮ
SO3(1)+NO(g)пјҢиҜҘеҸҚеә”зҡ„ О”Sпјң0
B . 2CO(g)=2C(s) + O2(g) О”Hпјһ0пјҢ й«ҳжё©дёӢеҸҜд»ҘиҮӘеҸ‘
C . C(sпјҢйҮ‘еҲҡзҹі)=C(sпјҢзҹіеўЁ) О”H= -1.9 kJВ·mol-1 пјҢ йҮ‘еҲҡзҹіжҜ”зҹіеўЁжӣҙзЁіе®ҡ
D . йҖүжӢ©й«ҳж•ҲеӮ¬еҢ–еүӮеҸҜд»ҘйҷҚдҪҺеҸҚеә”зҡ„з„“еҸҳпјҢжҸҗй«ҳеҢ–еӯҰеҸҚеә”йҖҹзҺҮ



