弱电解质在水溶液中的电离平衡 知识点
弱电解质在水溶液中的电离平衡 知识点题库
(1)常温下,0.1mol•L﹣1的H2C2O4的溶液的pH约为3,写出其电离方程式: .
(2)实验室常通过加热草酸(H2C2O4)的方法来获取一氧化碳.
①加热草酸分解反应的化学方程式为: .
②KHC2O4溶液呈酸性,则该溶液中c(HC2O4﹣) C (H2C2O4).(填“大于”“等于”或“小于”)
③KHC2O4溶液中离子浓度大小顺序: .
(3)实验室常用酸性高锰酸钾标准溶液滴定草酸来测定草酸溶液的浓度,判断滴定终点的现象是: ,其反应的离子方程式为: .
(4)草酸钴是制备氧化钴及钴粉的重要原料.在空气中对CoC2O4•2H2O持续加热时的热分解失重数据见下表.
(CoC2O4•2H2O相对分子质量183,固体失重率= )
)
序号 | 温度范围/℃ | 固体失重率 |
① | 120﹣220 | 19.67% |
② | 300﹣350 | 48.98% |
①120﹣220℃,CoC2O4•2H2O热分解的生成物为 .
②300﹣350℃,热分解的化学方程式为 .
-
(1) 醋酸溶液中c(H+)为,pH约为.
-
(2) 用滴定管取CH3COOH溶液20.00mL放在锥形瓶中,滴加几滴酚酞,待测.滴定管在使用前除洗涤外,还应.
-
(3) 判断到达滴定终点的实验现象是;
-
(4) 下列操作中,可能使所测CH3COOH溶液的浓度偏低的是A . 碱式滴定管未用标准碱液润洗就直接注入标准液 B . 读取碱液体积时,开始仰视读数,滴定结束时俯视读数 C . 碱式滴定管在滴定前有气泡,滴定后气泡消失 D . 滴定前盛放CH3COOH溶液的锥形瓶用蒸馏水洗净后没有干燥.
 不变
不变
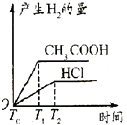 B .
B . 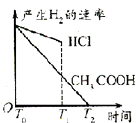 C .
C .  D .
D . 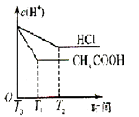
-
(1) 下列事实中,能证明碳酸是弱酸的是________A . 碳酸不稳定,易分解为二氧化碳和水 B . 用氢氧化钠溶液中和等浓度的碳酸溶液,需要氢氧化钠溶液的体积是碳酸体积的2倍 C . 相同条件下,碳酸的导电能力低于相同浓度的硫酸溶液 D . 常温下,5.0×10-6mol/L的碳酸溶液pH值为6
-
(2) 煤的燃烧也是导致温室效应的原因之一,其燃烧有下列两种途径:
途径I:C(s)+O2(g)=CO2(g) ΔH=Q1kJ/mol
途径II:先制水煤气:C(s)+H2O(g)=CO(g)+H2(g) ΔH=Q2kJ/mol
再燃烧水煤气:CO(g)+1/2O2(g)=CO2(g) ΔH=Q3kJ/mol
H2(g)+1/2O2(g)=H2O(g) ΔH=Q4kJ/mol
则Q1、Q2、Q3、Q4的数学关系式是;
-
(3) 常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10-5 mol/L。
①若忽略水的电离及H2CO3的第二级电离,则H2CO3
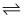 HCO3-+H+的平衡常数K1=,该步电离的电离度α=(已知:10-5.6=2.5×10-6 , 保留一位小数);
HCO3-+H+的平衡常数K1=,该步电离的电离度α=(已知:10-5.6=2.5×10-6 , 保留一位小数);②常温下,0.10 mol/L NaHCO3溶液的pH等于8.0,则此时溶液中c(H2CO3)c(CO32-)(填“>”“=”或“<”),原因是;(用离子方程式和必要的文字说明);
③向饱和碳酸溶液中分别加入下列物质,能使碳酸的第一步电离平衡向右移动的是
A.HCl气体 B.NaOH固体 C.Na单质 D.苯酚钠溶液
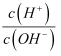 的关系如右图所示。下列说法错误的是( )
的关系如右图所示。下列说法错误的是( )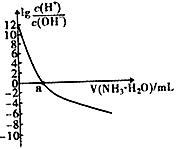
 ×10-9
D . 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
×10-9
D . 当滴入氨水的体积V=20mL时,溶液中存在c(NH4+)>c(A-)
-
(1) 画出砷的原子结构示意图。
-
(2) 工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式。该反应需要在加压下进行,原因是。
-
(3) 已知:As(s)+
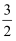 H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1 H2(g)+
 O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH22As(s)+
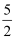 O2(g) =As2O5(s) ΔH3
O2(g) =As2O5(s) ΔH3则反应As2O5(s) +3H2O(l)= 2H3AsO4(s)的ΔH =。
-
(4) H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种 浓度之和的分数)与pH的关系分别如图所示。
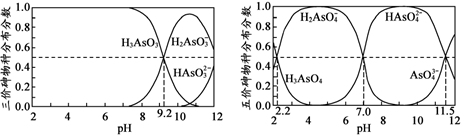
①以酚酞为指示剂(变色范围pH 8.0 ~ 10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为 。 ②H3AsO4第一步电离方程式H3AsO4
 H2AsO4-+H+的电离常数为Ka1,则pKa1=(pKa1 = -lg Ka1 )。
H2AsO4-+H+的电离常数为Ka1,则pKa1=(pKa1 = -lg Ka1 )。 -
(5) CO可用于合成甲醇,反应方程式为CO(g)+2H2(g)
 CH3OH(g)。
CH3OH(g)。 ①CO在不同温度下的平衡转化率与压强的关系如图1所示,该反应的ΔH0(填“>”或“<”)。
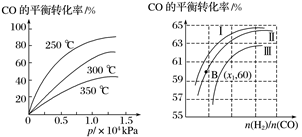
图表示CO的平衡转化率与起始投料比、温度的变化关系,测得B(x1,60)点氢气的转化率为40%,则x1=。
②一定条件下,将2 mol CO和2 mol H2置于容积为2 L固定的密闭容器中发生上述反应,反应达到平衡时CO与H2体积之比为2∶1,则平衡常数K=。
 C17H35COOC2H5+H218O
B . 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O
C17H35COOC2H5+H218O
B . 常温时,0.1 mol·L-1氨水的pH=11.1:NH3·H2O  NH4++OH−
C . 由Na和Cl形成离子键的过程:
NH4++OH−
C . 由Na和Cl形成离子键的过程: 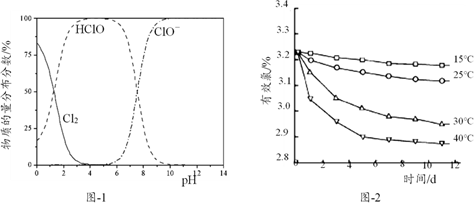
-
(1) 工业上常用NaOH溶液与Cl2反应制备NaClO。Cl2与冷的NaOH溶液反应的离子方程式为,当通入Cl2至溶液pH=5时,溶液中浓度最大的微粒是(填“Cl2”“ClO-”或“HClO”)。
-
(2) NaClO溶液在空气中易失效,其与空气中CO2反应的化学方程式为(已知H2CO3的Ka1、Ka2依次为4.47×10-7、4.68×10-11)。
-
(3) NaClO溶液可用于脱除黄磷生产尾气中PH3等有害气体。脱除PH3机理为:
H3O+ + ClO-= HClO + H2O
PH3 + HClO= [PH3O] + H++Cl-
[PH3O]+ClO-= H3PO2 + Cl-
室温下,用3%的NaClO溶液分别在pH=9、pH=11时处理含PH3的尾气,PH3的脱除率如图-3所示:

①下列措施能提高尾气中PH3的脱除率的是(填标号)。
A.增大尾气的流速
B.将吸收液加热到40℃以上
C.采用气、液逆流的方式吸收尾气
D.吸收尾气的过程中定期补加适量NaClO并调节合适的溶液pH
②已知PH3几乎不与NaOH溶液反应,黄磷生产尾气中除PH3外,还有大量的H2S等有害气体。黄磷尾气通过NaClO吸收液前需预先用30%NaOH溶液吸收处理,其目的是。
③pH=9时PH3的脱除率总是比pH=11的大,其原因是。
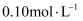
 溶液中加入少量
溶液中加入少量 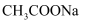 晶体,能使
晶体,能使  的电离度减小,溶液的
的电离度减小,溶液的  增大
B . 常温下,将
增大
B . 常温下,将  相同的盐酸和醋酸,均升温10℃,溶液
相同的盐酸和醋酸,均升温10℃,溶液  不相同
C . 将
不相同
C . 将 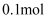 氯气溶于水,所得氯水中
氯气溶于水,所得氯水中 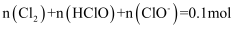 D .
D .  氨水中,
氨水中, 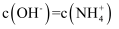
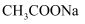 B .
B .  C .
C .  D .
D . 
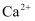 形成
形成  导致肾结石。下列说法正确的是( )
导致肾结石。下列说法正确的是( )
 溶液显中性
C .
溶液显中性
C .  能溶于水
D . 草酸溶液中
能溶于水
D . 草酸溶液中 
选项 | 实验操作和现象 | 实验结论 |
A | 测得0.1mol·L−1CH3COONa溶液pH约为9,0.1mol·L−1NaNO2溶液pH约为8 | HNO2电离出H+的能力比CH3COOH强 |
B | 向浓度均为0.1 mol·L−1的BaCl2和CaCl2混合溶液中滴加Na2SO4溶液,出现白色沉淀 | Ksp(BaSO4) < Ksp(CaSO4) |
C | 向溶有SO2的BaCl2溶液中通入气体X,出现白色沉淀 | X一定具有强氧化性 |
D | 卤代烃Y与NaOH水溶液共热后,再滴入AgNO3溶液,产生黑色沉淀 | 卤代烃已变质 |



