弱电解质在水溶液中的电离平衡 知识点题库
常温下,下列关于电解质溶液的说法正确的是( )
A . 将pH=4 CH3COOH溶液加水稀释10倍,溶液中各种离子浓度均减小
B . 用 CH3COOH溶液滴定等物质的量浓度的NaOH溶液至中性,V(CH3COOH溶液)<V(NaOH溶液)
C . 向0.2 mol•L﹣1的盐酸溶液中加入等体积0.1 mol•L﹣1NH3•H2O溶液:c(Cl﹣)+c(OH﹣)═c(H+)+c(NH3•H2O)
D . 在含0.1mol NaHSO4溶液中:c(H+)═c(SO  )+c(OH﹣)
)+c(OH﹣)
 )+c(OH﹣)
)+c(OH﹣)
对pH值相同的盐酸和醋酸两种溶液的说法正确的是( )
A . 中和碱的能力相同
B . 盐酸和醋酸的物质的量浓度相同
C . OH﹣的物质的量浓度相同
D . H+的物质的量浓度不同
一定温度下,甲、乙两瓶氨水的浓度分别为1mol/L和0.1mol/L,则甲、乙两瓶氨水中c(OH﹣)之比为( )
A . 小于10
B . 等于10
C . 大于10
D . 无法确定
已知电离平衡常数:H2CO3>HClO>HCO3﹣ , 下列有关叙述中正确的是( )
①若KI溶液中混有Br﹣ , 加入足量FeCl3溶液,用CCl4萃取后,取上层中的液体少许并加入AgNO3溶液,有淡黄色沉淀生成.
②向FeI2溶液中滴加少量氯水,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl﹣
③向NaClO溶液中通往少量二氧化碳的离子反应方程式为:2ClO﹣+CO2+H2O=2HClO+CO32﹣
④海水提溴过程中,用碳酸钠溶液吸收溴,溴歧化为Br﹣和BrO3﹣ , 其离子方程为:3Br2+6CO32﹣+3H2O=5Br﹣+BrO3﹣+6HCO3﹣ .
A . ②④
B . ①③
C . ②③
D . ①④
醋酸溶液中存在电离平衡:CH3COOH 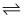 H++CH3COO- , 下列叙述不正确的是( )
H++CH3COO- , 下列叙述不正确的是( )
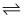 H++CH3COO- , 下列叙述不正确的是( )
H++CH3COO- , 下列叙述不正确的是( )
A . 升高温度,平衡正向移动,醋酸的电离常数Ka增大
B . 0.10 mol·L-1的CH3COOH溶液加水稀释,溶液中c(OH-)增大
C . CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D . 25 ℃时,欲使醋酸溶液的pH、电离常数Ka和电离程度都减小,可加入少量冰醋酸
H+浓度均为0.01mol/L的盐酸和醋酸各100mL分别稀释1.5倍后,再分别加入0.0325g锌粉,在相同条件下充分反应,有关叙述正确的是( )
A . 醋酸与锌反应放出氢气更多
B . 醋酸与锌反应放出氢气更少
C . 醋酸与锌反应速率更大
D . 盐酸和醋酸分别与锌反应的速率一样大
常温下,醋酸和氨水的电离常数均为1.8×10-5。现取浓度均为0.1mol/L的醋酸溶液与氨水各20mL,分别用0.1mol/L的NaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中pH滴加溶液的体积变化关系如图所示。下列说法正确的是( )

A . 曲线I中,滴加溶液到10mL时:2c(H+)+c(CH3COOH)=c(CH3COO-)+2c(OH-)
B . 曲线II中,滴加溶液到20mL时: c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C . 曲线II中,滴加溶液时始终存在: c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
D . 若将a和b两点对应的溶液混合,所得溶液常温下pH<7
在醋酸的电离过程中,加入水会使下列比值增大的是( )
A . c(CH3COOH)/c(CH3COO-)
B . c(CH3COO-)/c(OH-)
C . c(H+)/c(CH3COOH)
D . c(H+)/ c(OH-)
下列叙述正确的是( )
A . 95 ℃纯水的pH<7,说明加热可导致水呈酸性
B . pH = 3的醋酸溶液,稀释至10倍后pH = 4
C . 0.2 mol·L-1的盐酸,与等体积水混合后pH = 1
D . pH = 3的醋酸溶液,与pH = 11的氢氧化钠溶液等体积混合后pH = 7
下列说法正确的是( )
A . 用pH相同的氢氟酸和盐酸中和等体积等浓度的NaOH溶液,盐酸消耗的体积多
B . 相同温度下,pH相等的氨水和NaOH溶液,n(OH-)相等
C . 物质的量浓度相同的醋酸溶液和盐酸分别与镁反应,开始瞬间醋酸产生H2快
D . c(H+)=c(OH-)的溶液不一定呈中性
常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示,混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )
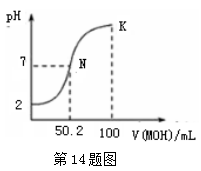
A . HA的电离方程式为:HA=H++A-
B . MOH为一元弱碱
C . K点对应的溶液中有:c(MOH)+c(M+)=0.02mol  L-1
D . N点对应的溶液中有:c(M+)=c(A-)
L-1
D . N点对应的溶液中有:c(M+)=c(A-)
常温下,关于pH值相同的醋酸和盐酸两种溶液,下列说法不正确的是( )
A . c(CH3COOH)>c(HCl)
B . c(CH3COO-)= c(Cl-)=c(H+)
C . 两种溶液中水的电离程度相同
D . 与等浓度的氢氧化钠溶液反应,醋酸消耗的体积少
常温下,向VmL 0.1mol·L-1HA溶液中滴入0.1mol·L-1NaOH溶液,溶液中由水电离出的氢离子浓度的负对数[-lgc水(H+)]与所加NaOH溶液体积的关系如图所示。下列说法不正确的是( )

A . 常温下,Ka(HA)约为10-5
B . P点溶液对应的pH=7
C . M点溶液中存在:c(Na+)=c(A-)+c(HA)
D . N点溶液中存在:c(Na+)≥c(A-)≥c(OH-)>c(H+)
常温下,用 0.1000 mol·L-1NaOH溶液滴定 20.00mL某未知浓度的CH3COOH溶液,滴定曲线如图所示。已知在点③处恰好中和。下列说法错误的是( )

A . 该温度下CH3COOH的电离平衡常数约为1.8 ×10-5
B . 点①处溶液中c(CH3COO-)<c(CH3COOH)
C . 点③处溶液中c(OH-)= c(CH3COOH)+c(H+)
D . 滴定过程中不可能出现:c(CH3COOH) >c(CH3COO-)> c(OH-)> c(Na+)> c(H+)
将①H+ ②Cl- ③Al3+ ④S2- ⑤K+ ⑥OH-⑦CH3COO- ⑧  ,分别加入H2O中,基本上不影响水的电离平衡的是( )
,分别加入H2O中,基本上不影响水的电离平衡的是( )
 ,分别加入H2O中,基本上不影响水的电离平衡的是( )
,分别加入H2O中,基本上不影响水的电离平衡的是( )
A . ①③⑤⑦⑧
B . ②④⑦
C . ②⑥⑦
D . ②⑤⑧
常温下,Ka (HCOOH)=1.77×10-4 , Ka (CH3COOH)=1.75×10-5 , Kb (NH3·H2O) =1.76×10-5 , 下列说法正确的是( )
A . 浓度均为0.1 mol·L-1的 HCOONa和NH4Cl溶液中阳离子的物质的量浓度之和:前者大于后者
B . 用相同浓度的NaOH溶液分别滴定等体积pH均为3的HCOOH和CH3COOH溶液至终点,消耗NaOH溶液的体积相等
C . 0.2 mol·L-1 HCOOH 与 0.1 mol·L-1 NaOH 等体积混合后的溶液中: c(HCOO-) + c(OH-) = c(HCOOH) + c(H+)
D . 0.2 mol·L-1 CH3COONa 与 0.1 mol·L-1盐酸等体积混合后的溶液中(pH<7): c(CH3COOH)> c(Cl- )>c(CH3COO-)>c(H+)
-
(1) 水是极弱的电解质,改变温度或加入某些电解质会影响水的电离.某温度下,纯水的
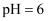 ,此温度25℃(填“>”、“<”或“=”),原因是;该温度下
,此温度25℃(填“>”、“<”或“=”),原因是;该温度下  的
的  溶液的
溶液的 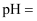 ;由水电离出的
;由水电离出的 
 。
。
-
(2) 体积均为
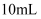 、pH均为2的一元酸
、pH均为2的一元酸 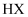 与
与  ,加水稀释过程中pH与溶液体积的关系如图所示,则酸性
,加水稀释过程中pH与溶液体积的关系如图所示,则酸性 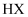
 (填“>”、“<”或“=”)
(填“>”、“<”或“=”)

-
(3) 25℃时,
 的
的 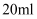 的
的  溶液与
溶液与 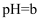 的
的 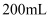 的
的  溶液混合后,溶液呈中性,则a和b满足的关系。
溶液混合后,溶液呈中性,则a和b满足的关系。
常温下,用pH传感器进行数字化实验,分别向两个盛50mL0.1000 mol∙L−1盐酸的烧杯中匀速滴加50mL蒸馏水、50mL0.1000m mol∙L−1醋酸铵溶液,滴加过程进行磁力搅拌,测得溶液pH随时间的变化如图所示。已知常温下醋酸铵溶液的pH=7,下列说法错误的是( )

A . 曲线X表示盐酸中加水稀释的pH变化,滴加过程中溶液中所有离子的浓度均逐渐减小
B . 曲线Y的pH变化主要是因为CH3COO-与H+结合成了弱电解质
C . a点对应的溶液中c(Cl-)+c(CH3COO-)+c(OH-)-c(  )=0.01 mol∙L−1
D . b点对应的溶液中水电离的c(H+)=10−12.86 mol∙L−1
)=0.01 mol∙L−1
D . b点对应的溶液中水电离的c(H+)=10−12.86 mol∙L−1
 )=0.01 mol∙L−1
D . b点对应的溶液中水电离的c(H+)=10−12.86 mol∙L−1
)=0.01 mol∙L−1
D . b点对应的溶液中水电离的c(H+)=10−12.86 mol∙L−1
归纳法是高中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
① pH =1的强酸溶液,加水稀释后,溶液中所有离子的浓度均降低
② pH=2的盐酸和pH=1的醋酸,c(H+)之比为2∶1
③在等物质的量浓度、等体积的氯化铵和氨水的混合溶液中存在下列关系c(NH4+)+2c(H+) =2c(OH-)+ c(NH3·H2O)
④反应2A (s) + B (g)=2C (g) + D (g) 不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka;醋酸根水解常数为Kh;水的离子积为Kw则三者关系为:Ka·Kh=Kw
⑥ 反应A(g)  2B(g);若正反应的活化能为Ea kJ·mol-1 , 逆反应的活化能为Eb kJ·mol-1 , 则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是( )
2B(g);若正反应的活化能为Ea kJ·mol-1 , 逆反应的活化能为Eb kJ·mol-1 , 则该反应的△H =(Ea-Eb)kJ·mol-1。其归纳正确的是( )
A . ①③⑤⑥
B . ③④⑤⑥
C . ②④⑤⑥
D . ①③④⑤
硼酸(H3BO3)的电离方程式为:H3BO3+H2O [B(OH)4]-+H+ , 电离时H3BO3结合溶液中的OH- , 使B原子最外层电子达到饱和结构,下列有关硼酸的说法正确的是( )
[B(OH)4]-+H+ , 电离时H3BO3结合溶液中的OH- , 使B原子最外层电子达到饱和结构,下列有关硼酸的说法正确的是( )
 [B(OH)4]-+H+ , 电离时H3BO3结合溶液中的OH- , 使B原子最外层电子达到饱和结构,下列有关硼酸的说法正确的是( )
[B(OH)4]-+H+ , 电离时H3BO3结合溶液中的OH- , 使B原子最外层电子达到饱和结构,下列有关硼酸的说法正确的是( )
A . 是一种三元弱酸
B . 硼酸能抑制水的电离
C . 与NaOH溶液反应的离子方程式:H3BO3+OH-=[B(OH)4]-
D . H3BO3与[B(OH)4]-中B原子的杂化方式相同
最近更新



