水的电离 知识点题库

-
(1) 若以A点表示25℃时水的电离平衡的离子浓度,当温度升高到100℃时,水的电离平衡状态移动到B点,则此时水的离子积从变化到。
-
(2) 将pH=8的Ba(OH)2溶液与pH=5的稀盐酸混合,并保持100℃的恒温,致使混合溶液的pH=7,则Ba(OH)2和盐酸的体积比为。
Ⅱ、有A、B、C、D四种强电解质,它们在水中电离时可产生下列离子(每种物质只含一种阴离子且互不重复):阳离子 Na+、Ba2+、NH4+ 阴离子 CH3COO-、Cl-、OH-、SO42-。已知:①A、C溶液的pH均大于7,A、B的溶液中水的电离程度相同;②C溶液和D溶液相遇时只生成白色沉淀,B溶液和C溶液相遇时只生成刺激性气味的气体,A溶液和D溶液混合时无明显现象。
①A是,B是 。
②用离子方程式表示A溶液呈碱性的原因。
 H++ OH-;ΔH > 0 ,下列叙述正确的是
H++ OH-;ΔH > 0 ,下列叙述正确的是

 减小
减小
-
(1) Ⅰ.常温下,如果取0.2 mol/LCH3COOH溶液与0.2 mol/L NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=9,试回答以下问题:
写出该混合过程中所发生反应的离子方程式:,混合溶液的pH=9的原因是:(用必要的文字和离子方程式表示)。
-
(2) 该混合溶液中由水电离出的c(H+)和pH=9的NaOH溶液中由水电离出c(H+)的比值为。
-
(3) 求该混合溶液中下列算式的计算结果:
c(Na+)-c(CH3COO-)=mol/L(代入数据,列出算式即可)
c(OH-)-c(CH3COOH)=moL/L。
-
(4) Ⅱ.由表格中的电离平衡常数判断可以发生的反应是_________(填字母序号)。
化学式
常温下的电离常数
HClO
K=3×10-8
H2CO3
K1=4.4×10-7 K2=4.7×10-11
A . NaClO+NaHCO3=HClO+Na2CO3 B . 2HClO+Na2CO3=2NaClO+CO2↑+H2O C . 2NaClO+CO2+H2O=2HClO+Na2CO3 D . NaClO+CO2+H2O=HClO+NaHCO3 -
(5) 将同温度下等浓度的下列四种盐溶液:(已知常温下一水合氨的电离常数Kb=1.8×10-5;碳酸的电离常数:Ka1=4.4×10-7 , Ka2=4.7×10-11)A . NH4HCO3 B . NH4Cl C . (NH4)2SO4 D . CH3COONH4 按pH由大到小的顺序排列:_________(填字母序号)。
-
(6) 下列固体物质溶于水,再将其溶液加热,蒸发结晶、再灼烧,能得到化学组成与原固体物质相同的是_________(填字母序号)。
①胆矾 ②氯化铝 ③硫酸铝 ④Na2CO3 ⑤NaHCO3 ⑥高锰酸钾
A . ③④ B . ①③④ C . ①②③④⑤ D . 全部

下列说法错误的是( )
-
(1) 已知部分弱酸的电离常数如下表:
弱酸
HF
CH3COOH
H2CO3
H2S
电离平衡常数(25℃)
Ka=7.2×10-4
Ka=1.75×10-5
Ka1=4.30×10-7
Ka2=5.61×10-11
Ka1=9.1×10-8
Ka2=1.1×10-12
①写出H2S的Ka1的表达式:。
②常温下,浓度相同的三种溶液NaF、Na2CO3、CH3COONa,pH由大到小的顺序是。
③将过量H2S通入Na2CO3溶液,反应的离子方程式是。
-
(2) 室温下,用0.100 mol·L-1盐酸溶液滴定20.00 mL 0.100 mol·L-1的氨水溶液,滴定曲线如图所示。

(忽略溶液体积的变化,①②填“>”“<”或“=”)
①a点所示的溶液中c (NH3·H2O)c (Cl-)。
②b点所示的溶液中c (Cl-)c (NH
 )。
)。③室温下pH=11的氨水与pH=5的NH4Cl溶液中,由水电离出的c (H+)之比为。
-
(3) 雌黄(As2S3)可转化为用于治疗白血病的亚砷酸(H3AsO3)可以用于治疗白血病,其在溶液中存在多种微粒形态,各种微粒物质的量分数与溶液的pH 关系如下图所示:

①人体血液的pH在7.35 -7.45之间,用药后人体中含砷元素的主要微粒是 。
②将KOH 溶液滴入亚砷酸溶液,当pH 调至11 时发生反应的离子方程式是。
③下列说法正确的是(填字母序号)
a.n(H3AsO3)∶n(H2AsO
 )=1∶1时,溶液显碱性
)=1∶1时,溶液显碱性b.pH=12时,溶液中c(H2AsO
 )+2c(HAsO
)+2c(HAsO  )+3c(AsO
)+3c(AsO  )+c(OH-)=c(H+)
)+c(OH-)=c(H+)c.在K3AsO3溶液中,c(AsO
 )>c(HAsO
)>c(HAsO  )>c(H2AsO
)>c(H2AsO  )
)

回答下列问题:
-
(1) 图中C点水的离子积常数为。
-
(2) A,B,C,D四点KW的关系是。
-
(3) 从A点到D点,可采取的措施是。
a.升温 b.加入少量盐酸 c.降温 d.加入少量NaOH
-
(4) 100℃时,pH=2的盐酸中水电离产生的H+浓度为。
-
(5) 25℃时,将pH=12的NaOH溶液与pH=3的H2SO4溶液混合,若所得混合溶液pH=7,则NaOH溶液与H2SO4溶液的体积比为。
-
(6) 室温下,实验测得0.1mol·L-1醋酸溶液的pH=3,下列说法正确的是
a.醋酸是弱电解质 b.醋酸电离使溶液中c(H+)>c(OH-)
c.醋酸电离出的H+抑制水的电离 d.溶液中的H+全部来自醋酸
 ,常温下,向0.1 mol·L-1的NaClO溶液中加入适量水,溶液酸度随加入水的体积变化如图所示。下列说法正确的是( )
,常温下,向0.1 mol·L-1的NaClO溶液中加入适量水,溶液酸度随加入水的体积变化如图所示。下列说法正确的是( ) 
 溶液和25mL 0.3mol/L
溶液和25mL 0.3mol/L 溶液中逐滴滴加0.3mol/L稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示,下列说法正确的是( )
溶液中逐滴滴加0.3mol/L稀盐酸,用压强传感器测得压强随盐酸体积的变化曲线如图所示,下列说法正确的是( )
 溶液的滴定曲线
B . b、c两点溶液中水的电离程度:b>c
C . a点溶液中
溶液的滴定曲线
B . b、c两点溶液中水的电离程度:b>c
C . a点溶液中 D . 取d点溶液加热煮沸后冷却至室温,溶液的pH不变
D . 取d点溶液加热煮沸后冷却至室温,溶液的pH不变
 变化的曲线如图所示。下列说法正确的是( )
变化的曲线如图所示。下列说法正确的是( )
 :
: C . a、b、c三点溶液中水的电离程度:
C . a、b、c三点溶液中水的电离程度: D . 将a、b两点溶液混合,所得溶液中:
D . 将a、b两点溶液混合,所得溶液中:

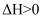 。回答下列问题:
。回答下列问题:
-
(1) 25℃时常压下,在pH=5的稀醋酸溶液中,c(CH3COO-)=mol/L(写出精确值)。下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是(填字母)。
a.加入少量0.10 mol/L的稀盐酸 b.加热该CH3COOH溶液
c.加入少量纯CH3COOH d.加水稀释至0.010 mol/L
e.加入少量氯化钠晶体 f.加入少量0.10 mol/L的NaOH溶液
-
(2) 将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)(填“>”、“<”或“=”,下同)V(醋酸)。
-
(3) 25℃下,向体积为
 的醋酸溶液中滴加
的醋酸溶液中滴加 的
的 溶液,溶液恰好呈中性,则Va与Vb的关系是:VaVb (填“>”、“<”或“=”)。
溶液,溶液恰好呈中性,则Va与Vb的关系是:VaVb (填“>”、“<”或“=”)。
-
(4) 已知90℃时,水的离子积常数为
 , 在此温度下将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合后溶液(温度保持90℃)中的c(H+)=(保留三位有效数字)mol/L
, 在此温度下将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合后溶液(温度保持90℃)中的c(H+)=(保留三位有效数字)mol/L
-
(5) 若25℃时CH3COOH的电离平衡常数
 , 向a LCH3COOH溶液中加入b mol CH3COONa,恢复至25℃,混合液呈中性,则原CH3COOH溶液的浓度为mol/L。
, 向a LCH3COOH溶液中加入b mol CH3COONa,恢复至25℃,混合液呈中性,则原CH3COOH溶液的浓度为mol/L。
 B . 稀醋酸加水稀释后,溶液中
B . 稀醋酸加水稀释后,溶液中 变大
C .
变大
C . 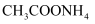 溶液和
溶液和 溶液均显中性,两溶液中水的电离程度相同
D . 两种氨水的pH分别为a和
溶液均显中性,两溶液中水的电离程度相同
D . 两种氨水的pH分别为a和 , 物质的量浓度分别为
, 物质的量浓度分别为 和
和 , 则
, 则



