溶液酸碱性的判断及相关计算 知识点题库
下列图示与对应的叙述不相符的是( )

A . 图1表示相同温度下,向pH=10的氢氧化钠溶液和氨水中分别加水稀释时pH的变化曲线,其中a表示氨水稀释时pH的变化曲线
B . 图2表示向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸所得沉淀物质的量与盐酸体积的关系
C . 图3表示压强对可逆反应CO(g)+H2O(g)⇌CO2(g)+H2(g)的影响,乙的压强比甲的压强大
D . 图4表示10 mL 0.01 mol•L﹣1KMnO4酸性溶液与过量的0.1 mol•L﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化(Mn2+对该反应有催化作用)
25℃时,向V mL pH=a的盐酸中,滴加10V mL pH=b的NaOH溶液,所得溶液中Cl﹣的物质的量恰好等于Na+的物质的量,则a+b的值是( )
A . 15
B . 14
C . 13
D . 不能确定
将V1mL 1.00mol•L﹣1盐酸和V2mL未知浓度NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL).下列叙述中,正确的是( )

A . 做实验时环境温度为22℃
B . NaOH溶液的浓度约是1.00mol•L﹣1
C . 该实验表明化学能可以转化为热能
D . 该实验表明有水生成的反应都是放热反应
在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
-
(1) 当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是.
-
(2) 同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是.
-
(3) 若三者c(H+)相同时,物质的量浓度由大到小的顺序是.
-
(4) 当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序.
-
(5) 当三者c(H+)相同且体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为,反应所需时间的长短关系是.
-
(6) 将c(H+)相同的三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是.
常温下,下列有关叙述正确的是( )
A . 0.1 mol•L﹣1醋酸溶液加水稀释后,各离子浓度均减小
B . pH=7的NH4Cl和氨水混合溶液中,c(NH4+)=c(Cl﹣)
C . 加热滴有酚酞的CH3COONa溶液,溶液颜色变浅
D . 0.1 mol•L﹣1 Na2CO3溶液中,c(HCO﹣3)>c(OH﹣)
在一隔热系统中,向20.00mL 0.01000mol•L﹣1的醋酸溶液中逐滴加入0.01000mol.L﹣1的NaOH溶液,测得混合溶液的温度变化如图.下列相关说法正确的是( )

A . 若a点溶液呈酸性,则a点有:c(CH3COO﹣)>c(Na+)>c(CH3COOH)
B . 从b到c:  逐渐增大
C . 水的电离程度:b点<c点
D . b点有0.01000mol•L﹣1+c(H+)=c(Na)+﹣c(CH3COOH)+c(OH﹣)
逐渐增大
C . 水的电离程度:b点<c点
D . b点有0.01000mol•L﹣1+c(H+)=c(Na)+﹣c(CH3COOH)+c(OH﹣)
 逐渐增大
C . 水的电离程度:b点<c点
D . b点有0.01000mol•L﹣1+c(H+)=c(Na)+﹣c(CH3COOH)+c(OH﹣)
逐渐增大
C . 水的电离程度:b点<c点
D . b点有0.01000mol•L﹣1+c(H+)=c(Na)+﹣c(CH3COOH)+c(OH﹣)
在常温下,下列各组溶液的c(H+)一定等于1×10﹣7mol/L的是( )
A . 将pH=5的CH3COOH溶液稀释100倍
B . 0.05mol/L H2SO4与0.10mol/L NaOH溶液以等体积混合
C . pH=2的盐酸和pH=12的氨水两种溶液以等体积混合
D . pH=1的H2SO4与0.10mol/L 的Ba(OH)2溶液以等体积混合
-
(1) Ⅰ.某烧碱样品含少量不与酸作用的杂质,为了测定其纯度,进行以下滴定操作:
A.在250 mL的容量瓶中定容配成250mL烧碱溶液
B.用移液管移取25 mL烧碱溶液于锥形瓶中并滴几滴指示剂甲基橙
C.在天平上准确称取烧碱样品Wg,在烧杯中用蒸馏水溶解
D.将物质的量浓度为c的标准盐酸溶液装入酸式滴定管,调节液面,记下开始读数为V1
E.在锥形瓶下垫一张白纸,滴定至终点,记下读数V2
回答下列各问题:
正确操作步骤的顺序是(用字母填写)→→→ D→。
-
(2) D步骤中液面应调节到,尖嘴部分应。
-
(3) 滴定终点时锥形瓶中颜色变化是。
-
(4) 若酸式滴定管不用标准盐酸润洗,在其他操作均正确的前提下,会对测定结果(指烧碱的纯度)有何影响?(填“偏高”、“低”或“不变”)
-
(5) 该烧碱样品纯度的计算式为。
-
(6) Ⅱ. 常温下,0.2 mol/L HCl溶液与0.2 mol/L MOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=6,则①混合溶液中由水电离出的c(H+)(填“>”、“<”或“=”)HCl溶液中由水电离出的c(H+)。
②求出混合溶液中下列算式的精确计算结果(填具体数字)。
c(Cl-)-c(M+)= mol/L;c(H+)-c(MOH)= mol/L。
-
(7) 常温下若将pH=3的HR溶液与pH=11的NaOH溶液等体积混合,测得混合溶液的pH≠7,则混合溶液的pH(填“>7”或“<7”或“无法确定”)。
等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种溶液滴加等浓度的盐酸将它们恰好中和,用去酸体积分别为V1、V2、V3,三者的大小关系正确的是( )
A . V1=V2= V3
B . V1=V2﹤V3
C . V1<V2 = V3
D . V1=V2﹥V3
某同学在实验报告中有以下实验数据记录,其中合理的是( )
A . 用托盘天平称取11.72g食盐
B . 用100mL的量筒量取25.00mL盐酸
C . 用pH试纸测得某稀醋酸溶液的pH为3.5
D . 用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40 mL HCl溶液
碳及其化合物在生产和生活中有重要意义。海水中CO2的吸收能力取决于溶解的碳酸盐和硼酸盐生成的CO32-和B(OH)4-浓度。已知:298K时,H3BO3+H2O  H++B(OH)4- , Ka=5.7×10-10 , 碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
H++B(OH)4- , Ka=5.7×10-10 , 碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
 H++B(OH)4- , Ka=5.7×10-10 , 碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
H++B(OH)4- , Ka=5.7×10-10 , 碳酸的电离平衡常数:Ka1=4.3×10-7;Ka2=5.6×10-11
-
(1) 298K时,相同浓度的碳酸钠溶液和硼酸钠溶液,pH较大的是溶液。
-
(2) 少量CO2与B(OH)4-反应的离子方程式为。
-
(3) 采用高温熔融混合碳酸盐LiaNabKcCO3作电解质吸收并电解CO2制得无定型炭是CO2 资源化利用的一种新途径。此法的阴极电极反应式为。
下列事实能说明醋酸(CH3COOH)是弱酸的是( )
A . 醋酸溶液能使紫色石蕊试液变红
B . 将pH=3的醋酸溶液稀释10倍,溶液的pH<4
C . 醋酸溶液能与鸡蛋壳反应生成二氧化碳
D . 等体积等浓度的醋酸溶液与氢氧化钠溶液恰好完全反应
下列根据实验操作和现象所得出的结论正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将浓硫酸滴到纸上 | 纸张变黑 | 浓硫酸具有吸水性 |
| B | 测定等浓度的Na2CO3和Na2SO3的溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| C | 向2.0ml浓度均为0.1mol·L-1的KCl、KI混合溶液中滴加1~2滴0.01mol·L-1AgNO3溶液,振荡 | 沉淀呈黄色 | Ksp(AgCl)>Ksp(AgI) |
| D | 将镁条点然后迅速伸入集满CO2的集气瓶 | 集气瓶中有浓烟和黑色颗粒 | CO2具有还原性 |
A . A
B . B
C . C
D . D
常温下,浓度均为0.1mol·L-1的四种溶液pH如下表,依据已有的知识和信息进行判断,下列说法正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 9.7 | 4.0 |
A . 常温下,HSO3-的水解能力强于其电离能力
B . 向氯水中加入少量NaHCO3固体,不能增大HClO的浓度
C . Na2CO3 溶液中存在以下关系:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-)
D . 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH依次升高
下列消毒剂呈碱性的是( )
A . 75%乙醇
B . 过氧乙酸消毒液
C . 双氧水
D . 84消毒液
常温下,用0.2mol·L-1盐酸滴定25.00mL0.2mol·L-1NH3·H2O溶液,所得溶液pH、NH  和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
 和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( )
和NH3·H2O的物质的量分数与滴加盐酸体积的关系如图所示。下列叙述正确的是( ) 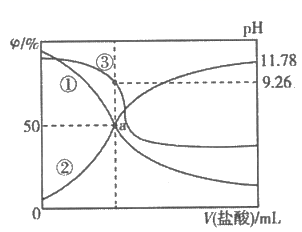
A . 曲线①代表φ(NH  ),曲线②代表φ(NH3·H2O)
B . a点溶液中存在c(Cl-)>c(NH
),曲线②代表φ(NH3·H2O)
B . a点溶液中存在c(Cl-)>c(NH  )=c(NH3·H2O)
C . NH3·H2O的电离常数的数量级为10-4
D . 应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色
)=c(NH3·H2O)
C . NH3·H2O的电离常数的数量级为10-4
D . 应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色
 ),曲线②代表φ(NH3·H2O)
B . a点溶液中存在c(Cl-)>c(NH
),曲线②代表φ(NH3·H2O)
B . a点溶液中存在c(Cl-)>c(NH  )=c(NH3·H2O)
C . NH3·H2O的电离常数的数量级为10-4
D . 应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色
)=c(NH3·H2O)
C . NH3·H2O的电离常数的数量级为10-4
D . 应选用甲基橙为指示剂,滴定终点溶液的颜色变化为黄色变为红色
下列溶液一定呈中性的是( )
A . pH=7的溶液
B . 使酚酞溶液呈无色的溶液
C . c(H+)=c(OH-)的溶液
D . c(H+)=10-7 mol/L的溶液
自然界是各类物质相互依存、各种变化相互制约的复杂平衡体系,而水溶液中的离子平衡是其中一个重要方面。请根据所学知识,回答下列问题:
-
(1) 常温下,在体积为20mL、浓度为0.1mol/LHA溶液中滴加0.1mol/LNaOH溶液,反应后溶液中水电离出的c(H+)表示为pH水=-lgc(H+)水。pH水与滴加NaOH溶液体积的关系如图所示。

①B点溶液中,离子浓度由大到小的顺序为:。
②HA的电离常数Ka= (请用含x的代数式表示)。
-
(2) 常温下,已知
 ,
,  。
。①0.1mol/L的CH3COOK溶液和0.1mol/LHCOONa溶液相比,

 (填“<”、“=”或“>”)。
(填“<”、“=”或“>”)。②向0.1mol/LHCOOH溶液中滴加相同浓度的NaOH溶液,当溶液中
 时,此时溶液的pH=。
时,此时溶液的pH=。 -
(3) 工业处理废水时,常加入FeS固体除去废水中的Hg2+ , 使其生成更难溶的HgS。请用平衡移动理论解释原因,写出反应的离子方程式。
常温下将NaOH溶液滴加到二元弱酸(H2A) 溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )

A . 曲线M表示pH与 的变化关系
B .
的变化关系
B .  =2.4时,溶液呈酸性
C . 当滴定到pH=7时,c(Na+)=c(A2-)+c(HA-)
D . 电离常数Ka1(H2A)的数量级为10-3
=2.4时,溶液呈酸性
C . 当滴定到pH=7时,c(Na+)=c(A2-)+c(HA-)
D . 电离常数Ka1(H2A)的数量级为10-3
 的变化关系
B .
的变化关系
B .  =2.4时,溶液呈酸性
C . 当滴定到pH=7时,c(Na+)=c(A2-)+c(HA-)
D . 电离常数Ka1(H2A)的数量级为10-3
=2.4时,溶液呈酸性
C . 当滴定到pH=7时,c(Na+)=c(A2-)+c(HA-)
D . 电离常数Ka1(H2A)的数量级为10-3
下列溶液一定呈酸性的是( )
A .  的溶液
B .
的溶液
B .  的溶液
C . 含有
的溶液
C . 含有 的溶液
D . 由水电离出的
的溶液
D . 由水电离出的 溶液
溶液
 的溶液
B .
的溶液
B .  的溶液
C . 含有
的溶液
C . 含有 的溶液
D . 由水电离出的
的溶液
D . 由水电离出的 溶液
溶液
最近更新



