溶液酸碱性的判断及相关计算 知识点题库
25℃时,用2a mol•L﹣1NaOH溶液滴定1.0L2a mol•L﹣1氢氟酸溶液,得到混合液中HF、F﹣的物质的量与溶液pH的变化关系如图所示.下列说法正确的是( )

A . pH=3时,溶液中:c(Na+)<c(F﹣)
B . c(F﹣)>c(HF)时,溶液一定呈碱性
C . pH=3.45时,NaOH溶液恰好与HF完全反应
D . pH=4时,溶液中:c(HF)+c(Na+)+c(H+)﹣c(OH﹣)<2amol•L﹣1
某温度下,0.200mol•L﹣1的HA溶液与0.200mol•L﹣1的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如下表,下列说法正确的是( )
微粒 | X | Y | Na+ | A﹣ |
浓度/(mol•L﹣1) | 8.00×10﹣4 | 2.50×10﹣10 | 0.100 | 9.92×10﹣2 |
A . 0.1mol•L﹣1HA溶液的pH=1
B . 该温度下Kw=1.0×10﹣14
C . 微粒X表示OH﹣ , Y表示H+
D . 混合溶液中:n(A﹣)+n(X)=n(Na+)
某酸HX的稀溶液和某碱YOH的稀溶液的物质的量浓度相等,两溶液混合后,溶液的pH大于7,表中判断合理的是( )
|
编号 |
HX |
YOH |
溶液的体积关系 |
|
① |
强酸 |
强碱 |
V(HX)=V(YOH) |
|
② |
强酸 |
强碱 |
V(HX)<V(YOH) |
|
③ |
强酸 |
弱碱 |
V(HX)=V(YOH) |
|
④ |
弱酸 |
强碱 |
V(HX)=V(YOH) |
A . ①③
B . ②③
C . ①④
D . ②④
25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示.下列叙述正确的是( )

A . HA溶液的物质的量浓度为0 01mol.L﹣1
B . b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C . a→b的过程中,混合溶液中可能存在:c(A﹣)=c(Na+)
D . 25℃时,HA的电离平衡常数K约为1.43×10﹣2
下列有关说法正确的是( )
A . 当H2O与Na2O2反应生成1molO2时,转移的电子数目为2×6.02×1023
B . 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗醋酸的体积更大
C . 常温下2S2O(g)═3S(s)+SO2(g)能自发进行,可推断该反应为吸热反应
D . 氯水通入SO2后溶液的酸性减弱
以0.10mol/L的氢氧化钠溶液滴定某一元酸HA的滴定曲线如图所示.下列表述正确的是( )

A . 此实验可以选用甲基橙作指示剂
B . 该酸HA的浓度约为1×10﹣4mol/L
C . 当NaOH体积为9 mL时,恰好完全中和反应
D . 达到滴定终点时,溶液中c(Na+)>c (A﹣)
25℃时,取浓度均为0.1mol/L的醋酸溶液和氨水溶液各20mL,分别用0.1mol/LNaOH溶液、0.1mol/L盐酸进行中和滴定,滴定过程中,pH随着滴加溶液的体积变化如图所示.下列说法不正确的是( )

A . 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO﹣)>c(Na+)>c(H+)>c(OH﹣)
B . 曲线Ⅱ:滴加溶液到10mL时:c(CH3COO﹣)﹣c(CH3COOH)═2[c(OH﹣)﹣c(H+)]
C . 曲线Ⅰ:滴加溶液在10mL﹣20mL之间存在:c(Cl﹣)═c(NH4+)>c(OH﹣)═c(H+)
D . 曲线Ⅰ:滴加溶液到20mL时:c(Cl﹣)>c(NH4+)>c(H+)>c(NH3•H2O)>c(OH﹣)
有关说法正确的是( )
A . 0.1mol/L NH4Cl溶液加蒸馏水稀释,溶液的pH不断减小
B . 常温下,pH=2的醋酸溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
C . NH4HSO4溶液中滴加NaOH溶液至溶液pH=7,则c(Na+)=2c(SO42﹣)
D . 0.1mol/L的NaHA溶液,其pH=4时:c(HA﹣)>c(H+)>c(H2A)>c(A2﹣)
已知常温下CH3COOH的电离常数为K,该温度下向20mL0.1mol/LCH3COOH溶液中逐滴加入0.1mol/LNaOH溶液,其pH变化曲线如图所示。下列说法错误的是( )

A . c点表示CH3COOH和NaOH恰好完全反应
B . b点表示的溶液中c (CH3COO-)>c(Na+)
C . a点表示的溶液中c (CH3COO-)略小于10-3mo1/L
D . b、d点表示的溶液中  均等于K
均等于K
 均等于K
均等于K
常温下,求下列溶液的pH(已知lg2=0.3)。
⑴0.1mol·L-1的CH3COOH溶液(已知CH3COOH的电离常数Ka=1.8×10-5)。
⑵0.1mol·L-1NH3·H2O溶液(NH3·H2O的电离度为α=1%,电离度= ![]() ×100%)。
×100%)。
⑶将pH=8的NaOH与pH=10的NaOH溶液等体积混合。
⑷将pH=5的盐酸与pH=9的NaOH溶液以体积比11∶9混合。
则(1)pH=;(2)pH=;(3)pH=;(4)pH=。
已知室温时,0.1 mol×L-1某一元酸HA的电离平衡常数约为1×10-7 , 下列叙述错误的是( )
A . 该溶液的pH=4
B . 此溶液中,HA约有0.1%发生电离
C . 由HA电离出的c(H+)约为水电离出的c(H+)的106倍
D . 加水稀释,HA的电离平衡向右移动,HA的电离平衡常数增大
下列关于溶液的酸碱性说法正确的是( )
A . c(H+)很小的溶液一定呈碱性
B . pH=7的溶液一定呈中性
C . c(H+)=c(OH-)的溶液一定呈中性
D . 不能使酚酞试液变红的溶液一定呈碱性
按要求填空:
-
(1) FeCl3的水溶液 pH7(填>、=、<),其原因为(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是(填化学式)
-
(2) 温度相同,浓度均为0.1mol•L-1的:①(NH4)2CO3 , ②(NH4)2Fe(SO4)2 , ③氨水,④NH4NO3 , ⑤NH4HSO4溶液,它们中的c(NH4+)由大到小的排列顺序是。 (用序号表示)
-
(3) 常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出c(H+)之比为。
-
(4) 室温,将pH=9的NaOH溶液与pH=4的盐酸溶液混合,若所得混合溶液的pH=6,则NaOH溶液与盐酸的体积比为。
高铁酸钾(K2FeO4)是一种优良的水处理剂。25℃,其水溶液中加酸或碱改变溶液的pH时,含铁粒子的物质的量分数δ(X)随pH的变化如图所示[已知  ]。下列说法正确的是( )
]。下列说法正确的是( )
 ]。下列说法正确的是( )
]。下列说法正确的是( ) 
A . K2FeO4、H2FeO4都属于强电解质
B . 由B点数据可知,H2FeO4的第一步电离常数Ka1=4.0×10-4
C . 25℃,H2FeO4(aq)+H+  H3FeO4+(aq)的平衡常数K>100
D . A,C两点对应溶液中水的电离程度不相等
H3FeO4+(aq)的平衡常数K>100
D . A,C两点对应溶液中水的电离程度不相等
 H3FeO4+(aq)的平衡常数K>100
D . A,C两点对应溶液中水的电离程度不相等
H3FeO4+(aq)的平衡常数K>100
D . A,C两点对应溶液中水的电离程度不相等
下列说法正确的是( )
A . pH=0的溶液不存在
B . 使用广泛pH试纸测得某溶液的pH=3.5
C . 中性溶液的pH不一定等于7
D . 酸或碱溶液在稀释时,溶液的pH均减小
常温下,下列有关pH的说法正确的是( )
A . 要使pH=5的CH3COOH溶液pH值增大3,可用加水稀释的方法
B . pH相同的HCl溶液和CH3COOH溶液,后者中和消耗NaOH的物质的量大
C . 甲溶液的pH=4,乙溶液的pH=5,两溶液中c(H+)之比c(H+)甲: c(H+)乙为1:10
D . pH=1的HNO3溶液中,水电离出来的c(H+)=1×10-13mol/L
在下列溶液中,pH 由大到小的排列顺序是( )
① 0.1 mol·L-1 KOH 溶液 ② 0.1 mol·L-1 CH3COOH 溶液 ③ 0.1 mol·L-1 HNO3溶液 ④ 0.1 mol·L-1 H2SO4溶液
A . ①②③④
B . ②①④③
C . ④③②①
D . ③④①②
下列说法正确的是( )
A . 强酸的水溶液中不存在OH-
B . pH=0的溶液是酸性最强的溶液
C . 25℃时溶液中由水电离出的c(H+)=1×10-11mol·L-1 , 该溶液显碱性
D . 温度不变时,加水稀释氢氧化钠溶液,溶液中离子浓度不能都减小
MOH和ROH两种一元碱的溶液分别加水稀释时,pH变化如图所示。下列叙述中不正确的是( )

A . MOH是一种弱碱
B . 在x点,c(M+)=c(R+)
C . 在x点,ROH完全电离
D . 稀释前,c(ROH)>10c(MOH)
小组探究Na2CO3和NaHCO3与碱的反应,实验过程及结果如下。
实验装置 | 试剂X | 实验结果 | ||
| I | II | III | ①II、III均产生白色沉淀 ②烧杯中溶液pH变化如下
|
蒸馏水 | 0.05mol·L−1 Na2CO3溶液 | 0.05mol·L−1 NaHCO3溶液 | ||
已知:pH越大,c(OH-)越大,溶液碱性越强。
下列说法不正确的是( )
A . I是空白实验,排除因体积变化对II、III溶液pH的影响
B . II和I的pH曲线基本重合,说明 与OH−不反应,II中发生反应:
与OH−不反应,II中发生反应: +Ca2+=CaCO3↓
C . III比II的pH曲线降低,说明
+Ca2+=CaCO3↓
C . III比II的pH曲线降低,说明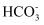 与OH−反应,III中初期发生反应:
与OH−反应,III中初期发生反应: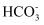 +OH−+Ca2+=CaCO3↓+H2O
D . III中石灰水恰好完全反应时,溶液pH=7
+OH−+Ca2+=CaCO3↓+H2O
D . III中石灰水恰好完全反应时,溶液pH=7
 与OH−不反应,II中发生反应:
与OH−不反应,II中发生反应: +Ca2+=CaCO3↓
C . III比II的pH曲线降低,说明
+Ca2+=CaCO3↓
C . III比II的pH曲线降低,说明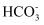 与OH−反应,III中初期发生反应:
与OH−反应,III中初期发生反应: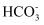 +OH−+Ca2+=CaCO3↓+H2O
D . III中石灰水恰好完全反应时,溶液pH=7
+OH−+Ca2+=CaCO3↓+H2O
D . III中石灰水恰好完全反应时,溶液pH=7
最近更新