溶液酸碱性的判断及相关计算 知识点题库
下列食物属碱性食物的是( )
A . 面包
B . 葡萄
C . 鸡蛋
D . 大米
常温时,用0.1000mol/L NaOH 滴定 25.00mL 0.1000mol/L某一元酸HX,滴定过程中pH 变化曲线如图所示.下列说法正确的是( )

A . 滴定前,酸中c(H+) 等于碱中c(OH﹣)
B . 在A点,c(Na+)>c(X﹣)>c(HX)>c(H+)>c(OH﹣)
C . 在B点,两者恰好完全反应
D . 在C点,c(X﹣)+c(HX)=0.05 mol/L
能说明0.1mol•L﹣1的NaHA溶液一定呈酸性的是( )
①稀释时,溶液中c(OH﹣)增大
②溶液的pH<7
③溶液中c(Na+)=c(A2﹣)
④溶液可与等体积等物质的量浓度的NaOH溶液恰好反应.
A . ①②③④
B . ①③④
C . ①③
D . ②④
下列说法正确的是( )
A . pH=11的氨水与pH=3的盐酸等体积混合:c(Cl﹣)=c(NH  )>c(OH﹣)=c(H+)
B . 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO﹣)
C . 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH
)>c(OH﹣)=c(H+)
B . 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO﹣)
C . 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH  )=0.1mol/L
D . pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7
)=0.1mol/L
D . pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7
 )>c(OH﹣)=c(H+)
B . 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO﹣)
C . 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH
)>c(OH﹣)=c(H+)
B . 0.2mol/L的CH3COOH溶液与0.1mol/L的NaOH溶液等体积混合:2c(Na+)=c(CH3COO﹣)
C . 浓度均为0.10mol/L的氨水和氯化铵溶液等体积混合后:c(NH3•H2O)+c(NH  )=0.1mol/L
D . pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7
)=0.1mol/L
D . pH=3的盐酸和pH=11的氢氧化钡等体积混合pH>7
常温下,对下列四种溶液的叙述正确的是( )
① | ② | ③ | ④ | |
pH | 10 | 10 | 4 | 4 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸溶液 | 盐酸 |
A . 四种溶液分别加水稀释10倍,pH变化最大的是①和④
B . ②、④两溶液相比,两者的kw相同
C . ①、②、③中分别加入少量的醋酸铵固体后,三种溶液的pH均减小
D . ①、④两溶液按一定体积比混合,所得溶液中离子浓度顺序一定为:c(NH4+)>c(Cl﹣)>c(H+)>c(OH﹣)
常温下,向20mL某浓度的硫酸溶液中滴入0.1mol•l﹣1氨水,溶液中水电离的氢离子浓度随加入氨水的体积变化如图.下列分析正确的是( )

A . V=40
B . C点所示溶液中:c(H+)﹣c(OH﹣)═2c(NH3•H2O)
C . d点所示溶液中:c(NH4+)═2c(SO42﹣)
D . NH3•H2O的电离常数K=10﹣4
常温下,如果取0.1mol•L﹣1 HA溶液与0.1mol•L﹣1 NaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8,试回答以下问题:
-
(1) 混合溶液的pH=8的原因:(用离子方程式表示).
-
(2) 混合溶液中由水电离出的c(OH﹣)(填“>”、“<”或“=”)0.1mol•L﹣1 NaOH溶液中由水电离出的 c(OH﹣).
-
(3) 求出混合溶液中下列算式的精确计算结果(填具体数字):c(OH﹣)﹣c(HA)=mol•L﹣1 .
-
(4) 已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的pH7(填“>”、“<”或“=”);将同温度下等浓度的四种盐溶液NH4+按由大到小的顺序排列是(填序号).
A.NH4HSO4 B.NH4A C.(NH4)2SO4 D.NH4Cl.
常温下,pH=11的氨水和pH=1的盐酸等体积混合后(不考虑溶液体积的变化),恰好完全反应.下列说法不正确的是( )
A . 原氨水物质的量浓度为0.1mol•L﹣1
B . 反应后的溶液中c(NH+4)+c (NH3•H2O)+c(NH3)=0.1mol•L﹣1
C . 反应后的溶液中:c(Cl﹣)>c(NH+4)>c(H+)>c( OH﹣)
D . 原氨水中:c(NH+4)+c(H+)=c(OH﹣)
某温度下,向一定体积 0.1mol/L 醋酸溶液中逐滴加入等浓度的NaOH溶液,溶液中pOH (pOH=﹣lg[OH﹣])与pH的变化关系如图所示,则( )

A . 溶液导电能力M点大于Q点
B . N点所示溶液中c(CH3COO﹣)>c(Na+)
C . M点和N点所示溶液中水的电离程度相同
D . 图中b>7
草酸(H2C2O4)是二元弱酸,KHC2O4溶液呈酸性.向10mL 0.01mol•L﹣1的H2C2O4溶液滴加0.01mol•L﹣1 KOH溶液V(mL),回答下列问题.
-
(1) 当V<10mL时,反应的离子方程式为.
-
(2) 当V=10mL时,溶液中HC2O4﹣、C2O42﹣、H2C2O4、H+的浓度从大到小的顺序为.
-
(3) 当V=a mL时,溶液中离子浓度有如下关系:c(K+)=2c(C2O42﹣)+c(HC2O4﹣);当V=b mL时,溶液中离子浓度有如下关系:c(K+)=c(C2O42﹣)+c(HC2O4﹣)+c(H2C2O4);则ab(填“<”“=”或“>”).
-
(4) 当V=20mL时,再滴入NaOH溶液,则溶液中
 的值将(填“变大”“变小”或“不变”).
的值将(填“变大”“变小”或“不变”).
室温下向10mL0.1mol/L NaOH溶液中加入0.1mol/L的一元酸HA,溶液pH的变化曲线如闬所示.下列说法正确的是( )

A . a 点所示溶液中 c(Na+)>c(A﹣)>c(H+)>c(HA)
B . a、b 两点所示溶液中水的电离程度相问
C . b点所示溶液中c(A﹣)>c(HA)
D . pH=7时,c(Na+)﹣=c(A﹣)+c(HA)
根据生活经验,下列物质pH大小正确的是( )
A . 白醋>酱油
B . 84消毒液>肥皂水
C . 人体胃液>人体血液
D . 厕所清洁剂>厨房清洁剂
下列溶液一定呈中性的是( )
A . pH=7的溶液
B . c(H+)=c(OH-)=10-6mol·L-1的溶液
C . 使酚酞溶液呈无色的溶液
D . 由强酸与强碱等物质的量反应得到的溶液
往10mL0.1mol/L的Ba(OH)2溶液中滴加等浓度NaHSO4溶液,溶液的导电能力随滴入溶液体积变化的曲线如图。下列说法正确的是( )

A . a点对应的溶液呈碱性
B . V2=10mL
C . 水的电离程度:a> b
D . b点后的溶液满足c(Na+)>2c(SO42-)
常温下,下列说法错误的是( )
A . pH 相等的盐酸和醋酸,加水稀释相同倍数后,醋酸的pH小于盐酸的pH
B . 0.1 mol•L-1 氨水的pH=a,加入适量的氯化铵固体可使溶液pH=a+1
C . 物质的量浓度相等的(NH4)2SO4溶液与(NH4)2CO3溶液中,  前者大于后者
D . pH为5的盐酸溶液稀释1000倍,pH<7
前者大于后者
D . pH为5的盐酸溶液稀释1000倍,pH<7
 前者大于后者
D . pH为5的盐酸溶液稀释1000倍,pH<7
前者大于后者
D . pH为5的盐酸溶液稀释1000倍,pH<7
25℃时,向20 mL 0.10 mol·L-1一元酸HA中逐滴加入0.10 mol·L-1 NaOH溶液,溶液pH与NaOH溶液体积的关系如图所示。下列说法正确的是( )

A . HA是强酸
B . a点,c(Na+) = c(A-) + c(HA)
C . b点为滴定终点,c(Na+) > c(A-)
D . c点,水的电离程度最大
常温下,用浓度为0.100 mol·L-1的NaOH溶液分别逐滴加入到20.00 mL 0.100 0 mol·L-1的HX、HY溶液中,pH随NaOH溶液体积的变化如图。下列说法正确的是( )

A . V(NaOH)=10.00 mL时,两份溶液中c(X-)>c(Y-)
B . V(NaOH)=10.00 mL时,c(X-)>c(Na+)>c(HX)>c(H+)>c(OH-)
C . V(NaOH)=20.00 mL时,c(OH-)>c(H+)>c(Na+)>c(X-)
D . pH=7时,两份溶液中c(X-)=c(Na+)=c(Y-)
常温下,浓度均为0.1mol/L的三种溶液:①CH3COOH溶液②NaOH溶液③CH3COONa溶液,下列说法中正确的是(忽略混合前后溶液体积变化)( )
A . 溶液的pH值:①>③>②
B . 水电离出的c(OH-):③>①=②
C . ①和③等体积混合后的溶液:c(CH3COOH)+c(CH3COO-)=0.1mol/L
D . ②和③等体积混合后的溶液:c(Na+)=c(CH3COOH)+c(CH3COO-)
50 ℃时水的离子积 Kw =3.0×10 - 14 ,则在 50 ℃时,c(OH - )=1×10 - 7 mol·L-1 的溶液( )
A . 呈酸性
B . 呈碱性
C . 呈中性
D . 无法判断
下列溶液一定显酸性的是( )
A . 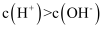 B . 含有
B . 含有 C .
C .  D . 酚酞变红
D . 酚酞变红
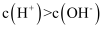 B . 含有
B . 含有 C .
C .  D . 酚酞变红
D . 酚酞变红
最近更新



