离子浓度大小的比较 知识点
离子浓度大小的比较 知识点题库
 )相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B . 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
C . 1.0 mol/L Na2CO3溶液:c(OH﹣)=c(HCO
)相等的(NH4)2SO4、NH4HSO4、NH4Cl溶液中:c(NH4HSO4)>c[(NH4)2SO4]>c(NH4Cl)
B . 向醋酸钠溶液中加入适量醋酸,得到的酸性混合溶液:c(Na+)>c(CH3COO﹣)>c(H+)>c(OH﹣)
C . 1.0 mol/L Na2CO3溶液:c(OH﹣)=c(HCO  )+c(H+)+2c(H2CO3)
D . 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HA﹣)+c(A2﹣)
)+c(H+)+2c(H2CO3)
D . 某二元弱酸的酸式盐NaHA溶液中:c(H+)+c(Na+)=c(OH﹣)+c(HA﹣)+c(A2﹣)
-
(1) 人体内草酸累积过多是导致结石(主要成分是草酸钙)形成的原因之一.有研究发现,EDTA(一种能结合金属离子的试剂)在一定条件下可以有效溶解结石,用化学平衡原理解释其原因:.
-
(2) 已知:0.1mol•L﹣1KHC2O4溶液呈酸性.下列说法正确的是(填字母序号).
a.0.1mol•L﹣1KHC2O4溶液中:c(K+)+c(H+)=c(HC2O4﹣)+2c(C2O42﹣)+c(OH﹣)
b.0.1mol•L﹣1 KHC2O4溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(H2C2O4)
c.浓度均为0.1mol•L﹣1 KHC2O4和K2C2O4的混合溶液中:2c(K+)=c(HC2O4﹣)+c(C2O42﹣)
d.0.1mol/L KHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+).
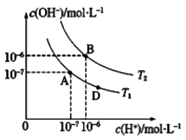
 D . 图中D点处溶液中离子浓度:c(Na+)>c(X-)
D . 图中D点处溶液中离子浓度:c(Na+)>c(X-)
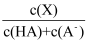 ]下列说法正确的是( )
]下列说法正确的是( ) 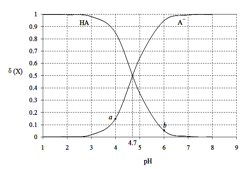
 与pH的关系如图所示,C点坐标是(6,1.7)。(已知:lg5=0.7)下列说法正确的是( )
与pH的关系如图所示,C点坐标是(6,1.7)。(已知:lg5=0.7)下列说法正确的是( ) 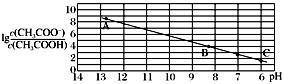
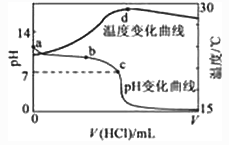
下列说法错误的是( )
①0.1mol/LHCl溶液;②0.1mol/LH2SO4溶液;③0.1mol/LNaOH溶液;④0.1mol/LCH3COOH溶液
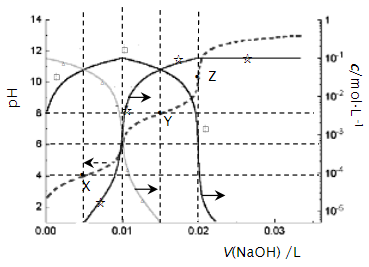
下列说法中正确的是( )
 )
)
 ,
,  下列说法正确的是( )
下列说法正确的是( )
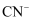 的水解常数
的水解常数 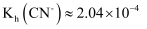 B . 25℃时,反应
B . 25℃时,反应 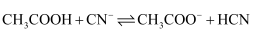 的平衡常数
的平衡常数 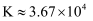 C . 同浓度的
C . 同浓度的 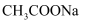 溶液和NaCN溶液中,
溶液和NaCN溶液中, 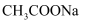 溶液的离子总浓度较小
D . 若加水稀释醋酸溶液,溶液中所有离子浓度均减小
溶液的离子总浓度较小
D . 若加水稀释醋酸溶液,溶液中所有离子浓度均减小

 的蒸馏水中加入
的蒸馏水中加入  晶体,保持温度不变,测得溶液中
晶体,保持温度不变,测得溶液中 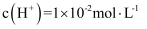 。下列对该溶液的叙述错误的是( )
。下列对该溶液的叙述错误的是( )
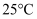 B . 由水电离出来的
B . 由水电离出来的  的浓度为
的浓度为  C . 加入
C . 加入  晶体后抑制水的电离
D . 加水稀释,溶液中的
晶体后抑制水的电离
D . 加水稀释,溶液中的  减小
减小
 。
。已知:PCl3、POCl3的部分性质如下:
熔点/℃ | 沸点/℃ | 其它 | |
PCl3 |
| 75.5 | 遇水生成H3PO3和HCl |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl |
某兴趣小组模拟该工艺设计实验装置如图(某些加持装置、加热装置已略去):
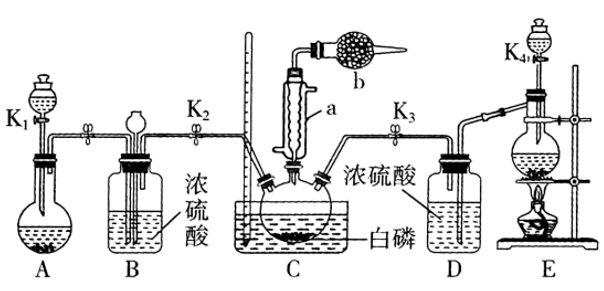
-
(1) 检查装置气密性并加入纯净的白磷,先制取一种气体,缓慢地通入C中,直至C中的白磷完全消失后,再通入另一种气体。仪器a的名称为,b中盛放的药品是。
-
(2) C中反应温度控制在60~65℃,不能过高或过低的原因是。
-
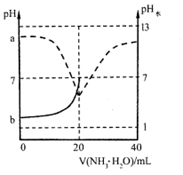
(3) PCl3遇水生成H3PO3 , 常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与所有含磷粒子浓度变化的关系如图所示。
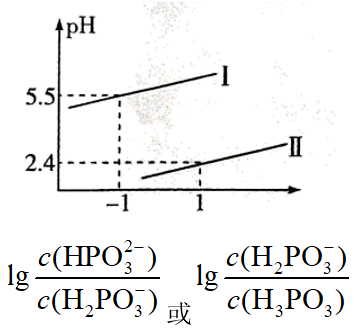
其中表示
 的是曲线 (填“I”或“II”),Na2HPO3溶液中,各离子浓度由大到小的顺序为。
的是曲线 (填“I”或“II”),Na2HPO3溶液中,各离子浓度由大到小的顺序为。 -
(4) 通过测定三氯氧磷产品中Cl元素含量,可进一步计算产品的纯度,实验步骤如下:
①取a g产品置于盛60.00 mL蒸馏水的水解瓶中,摇动至完全水解,将水解液配成100.00 mL溶液并预处理排除含磷粒子的影响。
②取10.00 mL溶液于锥形瓶中,向其中加入c1 mol/L的AgNO3溶液V1 mL,使Cl-完全沉淀,再加入20 mL硝基苯,振荡,使沉淀表面被有机物覆盖;然后加入几滴Fe(NO3)3溶液作指示剂,用c2 mol/LNH4SCN溶液滴定过量Ag+至终点,记下所用体积为V2 mL。[已知:
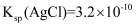 ,
, 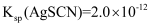 ]则产品中POCl3的百分含量为(填表达式)。实验过程中加入硝基苯的目的是;若无此操作,则所测POCl3的含量将 (填“偏高”、“偏低”或“不变”)。
]则产品中POCl3的百分含量为(填表达式)。实验过程中加入硝基苯的目的是;若无此操作,则所测POCl3的含量将 (填“偏高”、“偏低”或“不变”)。
 HR-
HR- R2-。常温下,向一定浓度的H2R溶液中滴加NaOH溶液,混合溶液中lgx[x表示
R2-。常温下,向一定浓度的H2R溶液中滴加NaOH溶液,混合溶液中lgx[x表示 或
或 ]随pOH[pOH=- lgc(OH- )] 的变化如图所示。下列说法正确的是( )
]随pOH[pOH=- lgc(OH- )] 的变化如图所示。下列说法正确的是( )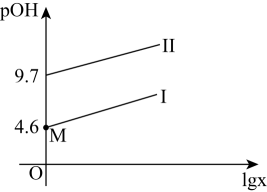
 的变化关系
D . M点时,c(H+ )+c(Na+ )=c(OH-)+3c(HR-)
的变化关系
D . M点时,c(H+ )+c(Na+ )=c(OH-)+3c(HR-)
 的关系如图所示。下列说法正确的是( )
的关系如图所示。下列说法正确的是( )
 的变化曲线
B . Ksp(SrF2)的数量级为10-7
C . a、c两点的溶液中均存在2c(Sr2+)=c(F -)+c(HF)
D . c点的溶液中存在c(Cl-)< c(Sr2+)
的变化曲线
B . Ksp(SrF2)的数量级为10-7
C . a、c两点的溶液中均存在2c(Sr2+)=c(F -)+c(HF)
D . c点的溶液中存在c(Cl-)< c(Sr2+)
 溶液中:
溶液中: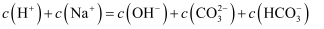 B . 常温下
B . 常温下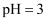 的
的 与
与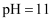 的NaOH溶液等体积混合后的溶液中:
的NaOH溶液等体积混合后的溶液中: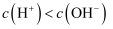 C .
C .  的
的 溶液中:
溶液中: D . 物质的量浓度相等的
D . 物质的量浓度相等的 和
和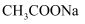 溶液等体积混合后的溶液中:
溶液等体积混合后的溶液中: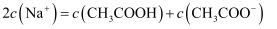
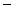 112
112


