离子浓度大小的比较 知识点题库
已知常温下,0.1mol•L﹣1的HA溶液中  =1×10﹣8 , 下列叙述中正确的是( )
=1×10﹣8 , 下列叙述中正确的是( )
 =1×10﹣8 , 下列叙述中正确的是( )
=1×10﹣8 , 下列叙述中正确的是( )
A . 0.01 mol•L﹣1HA的溶液中 c(H+)=l×10﹣4mol•L﹣1
B . pH=3的HA溶液与pH=ll的NaOH溶液等体积混合后所得溶液中:c(Na+)=c(A﹣)>c(OH﹣)=c(H+)
C . 浓度均为0.1 mol•L﹣1的HA溶液和NaA溶液等体积混合后所得溶液显酸性,则c(H+)﹣c(OH﹣)>c(A﹣)﹣c(HA)
D . pH=3的HA溶液与pH=11的NaOH溶液混合后所得溶液显碱性,则 c(Na+)>c(A﹣)>c(OH﹣)><c(H+)
向amol/L的氨水中加入等体积b mol•L-1的盐酸,下列关系错误的是( )
A . 当a=b时,c(H+)=c(OH-)+c(NH3·H2O)
B . 当a>b时,c(NH4+)+c(NH3·H2O) >c(Cl-)
C . 当a<b时,c(NH4+)>c(Cl-)>c(OH-)>c(H+)
D . 当a与b为任意比时,c(NH4+)+c(H+)=c(Cl-)+c(OH-)
已知亚硒酸(H2SeO3)为二元弱酸,常温下,向某浓度的亚硒酸溶液中逐滴加入一定浓度的NaOH溶液,所得溶液中H2SeO3、HSeO3-、SeO32-三种微粒的物质的量分数与溶液pH 的关系如图所示。下列说法错误的是( )

A . 常温下,亚硒酸的电离平衡常数K2=10-4.2
B . pH=1.2的溶液中:c(Na+)+c(H+)=c(OH-)+c(H2SeO3)
C . 将相同物质的量NaHSeO3和Na2SeO3 固体完全溶于水可配得pH为4.2的混合液
D . 向pH=1.2的溶液中滴加NaOH溶液至pH=4.2的过程中水的电离程度一直增大
常温下,向20 mL某浓度的硫酸中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是( )

A . 该硫酸的浓度为1 mol·L-1
B . b点所示溶液中:c(  )=c(
)=c(  )
C . V=40
D . c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
)
C . V=40
D . c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
常温下有浓度均为0.5 mol/L的四种溶液:
①Na2CO3溶液 ②NaHCO3溶液 ③HCl溶液 ④氨水
-
(1) 上述溶液中,可发生水解的是(填序号,下同)。
-
(2) 上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为。
-
(3) 向④中加入少量氯化铵固体,此时c(NH4+)/c(OH-)的值(填“增大”、“减小”或“不变”)。
-
(4) 若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积④的体积(填“大于”、“小于”或“等于”),此时溶液中离子浓度由大到小的顺序是。
-
(5) 取10 mL溶液③,加水稀释到500 mL,则此时溶液中由水电离出的c(H+)=。
关于小苏打水溶液的表述正确的是( )
A . c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
B . c(Na+)+c(H+) = c(HCO3-) + c(CO32-) + c(OH-)
C . HCO3-的电离程度大于HCO3-的水解程度
D . 存在的电离有:NaHCO3 = Na++ HCO3- ,HCO3- = H++ CO32-
工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)  2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
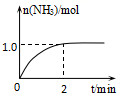
-
(1) 0~2min内的平均反应速率v(H2)=。
-
(2) 该温度下,反应的平衡常数表达式K=。
其平衡常数K与温度T的关系如下表:

试判断K1K2(填写“>”、“=”或“<”)。
-
(3) 能说明该合成氨反应已达到平衡状态的是(选填编号)。
a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1 , c(H2)=c(N2)=0.01mol·L-1
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
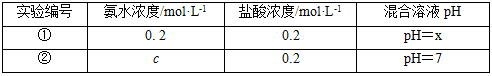
请回答:
-
(4) ①中所得混合溶液,pH7(填“>”、“<”或“=”);②中c 0.2(填“>”、“<”或“=”),所得混合溶液中各离子浓度大小关系为。
-
(5) 请你设计一个能证明一水合氨是弱电解质的简要方案。
25℃时,体积均为25.00mL,浓度均为0.0100mo1•L-1的HA、H3B溶液分别用0.0100mo1•L-1NaOH溶液滴定,溶液的pH随V(NaOH)变化曲线如图所示,下列说法正确的是( )

A . 25℃时,0.0100mo1•L-1Na2HB溶液的pH>7
B . 向HA溶液中滴加NaOH溶液至中性,c(A-)<c(HA)
C . NaOH溶液滴定HA溶液应选甲基橙作指示剂
D . 25℃时,H2B-离子的水解常数的数量级为10-3
25℃时,用浓度为0.01mol·L-1的HA溶液滴定20mL浓度为0.01mol·L-1的NaOH溶液,滴定曲线如图所示。下列说法错误的是( )

A . 应选用酚酞作指示剂
B . M点溶液中存在:c(Na+)>c(A-)
C . Ka(HA)≈2×10-8
D . N点溶液中存在:c(OH-)-c(H+)=c(HA)
连二次硝酸(H2N2O2)是一种二元酸,可用于制N2O气体。
-
(1) 常温下,用0.01mol·L-1的NaOH溶液滴定10mL0.01mol·L-1H2N2O2溶液,测得溶液pH与NaOH溶液体积的关系如图所示。

①写出H2N2O2在水溶液中的电离方程式:。
②c点时溶液中各离子浓度由大到小的顺序为。
③b点时溶液中c(H2N2O2)c(N2O22-)。(填“>”“<”或“=”,下同)
④a点时溶液中c(Na+)c(HN2O)+c(N2O22-)。
-
(2) 硝酸银溶液和连二次硝酸钠溶液混合,可以得到黄色的连二次硝酸银沉淀,向该分散系中滴加硫酸钠溶液,当白色沉淀和黄色沉淀共存时,分散系中
 =。[已知Ksp(Ag2N2O2)=4.2×10-9 , Ksp(Ag2SO4)=1.4×10-5]
=。[已知Ksp(Ag2N2O2)=4.2×10-9 , Ksp(Ag2SO4)=1.4×10-5]
-
(3) 有时我们将NaHCO3溶液中的平衡表示为:2HCO3-
 H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理___(填序号)
A . 适当浓度的盐酸 B . 适当浓度Ba(OH)2溶液 C . 适当浓度BaCl2溶液
H2CO3+CO32-;为了证明该平衡存在,你认为应向NaHCO3溶液中加入下列哪种试剂合理___(填序号)
A . 适当浓度的盐酸 B . 适当浓度Ba(OH)2溶液 C . 适当浓度BaCl2溶液
25℃时,向10 mL0.10 mol/L的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10 mol/L NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。若溶液混合引起的体积变化可忽略,下列说法正确的是( )

A . a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B . pH=7时,V1>10 mL
C .  点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D . V=10 mL时,c(HA)+c(A-)+c(Na+)=0.20 mol/L
点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D . V=10 mL时,c(HA)+c(A-)+c(Na+)=0.20 mol/L
 点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D . V=10 mL时,c(HA)+c(A-)+c(Na+)=0.20 mol/L
点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D . V=10 mL时,c(HA)+c(A-)+c(Na+)=0.20 mol/L
贵州长期受到酸雨污染的困扰,主要原因是企业和家庭直接使用燃煤时,废气未经处理直接排放到空气中,近年来,酸雨治理的成效非常显著。2020年6月份的某个雨天,遵义市气象台的实验人员收集了150mL雨水,并分析了雨水中的离子及其浓度,结果统计如下:
| 离子 | | Cl- | Na+ | | |
| 浓度/10-5mol/L | 5.1 | 4.3 | 4.8 | 2.1 | 2.0 |
则这次雨水的pH值约是(lg2=0.3) ( )
A . 4.5
B . 5.3
C . 5.6
D . 4.7
室温时,下列溶液中微粒的物质的量浓度关系正确的是( )
A . pH=8的NaClO溶液中:c(Na+)>c(ClO-)>c(OH-)>c(H+)
B . 新制氯水中:c(H+)=c(HClO)+c(ClO-)+c(OH-)
C . 0.1 mol/L HCl溶液与0.2 mol/L NH3·H2O溶液等体积混合后pH>7:c(NH3·H2O)>c(Cl-)>c(NH  )>c(OH-)
D . 0.1 mol/L K2C2O4溶液与0.2 mol/L KHC2O4溶液等体积混合:4c(K+)=3[c(C2O
)>c(OH-)
D . 0.1 mol/L K2C2O4溶液与0.2 mol/L KHC2O4溶液等体积混合:4c(K+)=3[c(C2O 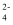 )+c(HC2O
)+c(HC2O  )+c(H2C2O4)]
)+c(H2C2O4)]
 )>c(OH-)
D . 0.1 mol/L K2C2O4溶液与0.2 mol/L KHC2O4溶液等体积混合:4c(K+)=3[c(C2O
)>c(OH-)
D . 0.1 mol/L K2C2O4溶液与0.2 mol/L KHC2O4溶液等体积混合:4c(K+)=3[c(C2O 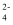 )+c(HC2O
)+c(HC2O  )+c(H2C2O4)]
)+c(H2C2O4)]
常温下将  溶液滴加到
溶液滴加到  溶液中,混合溶液的
溶液中,混合溶液的  与离子浓度变化的关系如图所示(纵坐标为
与离子浓度变化的关系如图所示(纵坐标为  或
或  。下列叙述错误的是( )
。下列叙述错误的是( )
 溶液滴加到
溶液滴加到  溶液中,混合溶液的
溶液中,混合溶液的  与离子浓度变化的关系如图所示(纵坐标为
与离子浓度变化的关系如图所示(纵坐标为  或
或  。下列叙述错误的是( )
。下列叙述错误的是( ) 
A . 曲线M表示  与
与  B . 图中a点对应溶液中:
B . 图中a点对应溶液中:  C .
C .  与
与  之比为
之比为 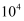 D .
D . 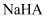 溶液中:
溶液中: 
 与
与  B . 图中a点对应溶液中:
B . 图中a点对应溶液中:  C .
C .  与
与  之比为
之比为 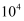 D .
D . 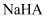 溶液中:
溶液中: 
常温下,向饱和氯水中逐滴滴入0.1 mol/L的氢氧化钠溶液,pH变化如下图所示,下列有关叙述正确的是( )

A . ①点所示溶液中只存在HClO的电离平衡
B . ①点所示溶液中:  C . ②点所示溶液中:
C . ②点所示溶液中:  D . ①到②水的电离程度逐渐减小
D . ①到②水的电离程度逐渐减小
 C . ②点所示溶液中:
C . ②点所示溶液中:  D . ①到②水的电离程度逐渐减小
D . ①到②水的电离程度逐渐减小
25℃,向20.00 mL 0.100 mol·L−1 CH3COOH中滴加0.100 mol·L−1 NaOH过程中,pH变化如图所示。

-
(1) A点溶液pH1.(填“>”、“<”或“=”)。
-
(2) 下列有关B点溶液的说法正确的是(填字母序号)。
a.溶质为:CH3COOH、CH3COONa
b.微粒浓度满足:c(Na+) + c(H+) = c(CH3COO−) + c(OH−)
c.微粒浓度满足:c(Na+) = c(CH3COOH) + c(CH3COO−)
-
(3) A、C两点水的电离程度:AC(填“>”、“<”或“=”)。
-
(4) 滴加 20 mL NaOH 溶液时,D点溶液的pH >7,原因是(用离子方程式表示)。
室温下,通过下列实验探究 溶液的性质(假设实验前后溶液体积不变)。
溶液的性质(假设实验前后溶液体积不变)。
 溶液的性质(假设实验前后溶液体积不变)。
溶液的性质(假设实验前后溶液体积不变)。实验 | 实验操作和现象 |
1 | 用pH试纸测定 |
2 | 向 |
3 | 向 |
4 | 向 |
下列说法正确的是( )
A .  溶液中存在
溶液中存在 B . 实验2中沉淀仅为
B . 实验2中沉淀仅为 C . 实验3得到的溶液中有
C . 实验3得到的溶液中有 D . 实验4中发生反应的离子方程式为
D . 实验4中发生反应的离子方程式为
 溶液中存在
溶液中存在 B . 实验2中沉淀仅为
B . 实验2中沉淀仅为 C . 实验3得到的溶液中有
C . 实验3得到的溶液中有 D . 实验4中发生反应的离子方程式为
D . 实验4中发生反应的离子方程式为
下列说法正确的是( )
A . 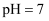 的溶液中
的溶液中 、
、 、
、 、
、 能大量共存
B . 相同温度下,
能大量共存
B . 相同温度下, 醋酸溶液与
醋酸溶液与 醋酸溶液中
醋酸溶液中 之比小于
之比小于 C . 等物质的量浓度①
C . 等物质的量浓度① 、②NH4Al(SO4)2溶液中
、②NH4Al(SO4)2溶液中 浓度的大小顺序为①>②
D . 常温下,
浓度的大小顺序为①>②
D . 常温下, 均为
均为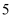 的氯化铵溶液和醋酸溶液中水的电离程度相同
的氯化铵溶液和醋酸溶液中水的电离程度相同
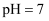 的溶液中
的溶液中 、
、 、
、 、
、 能大量共存
B . 相同温度下,
能大量共存
B . 相同温度下, 醋酸溶液与
醋酸溶液与 醋酸溶液中
醋酸溶液中 之比小于
之比小于 C . 等物质的量浓度①
C . 等物质的量浓度① 、②NH4Al(SO4)2溶液中
、②NH4Al(SO4)2溶液中 浓度的大小顺序为①>②
D . 常温下,
浓度的大小顺序为①>②
D . 常温下, 均为
均为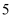 的氯化铵溶液和醋酸溶液中水的电离程度相同
的氯化铵溶液和醋酸溶液中水的电离程度相同
室温下,向20mL浓度均为0.1 的
的 和
和 混合液中逐滴加入0.1
混合液中逐滴加入0.1 NaOH溶液,溶液pH变化曲线如图。下列说法错误的是( )
NaOH溶液,溶液pH变化曲线如图。下列说法错误的是( )
 的
的 和
和 混合液中逐滴加入0.1
混合液中逐滴加入0.1 NaOH溶液,溶液pH变化曲线如图。下列说法错误的是( )
NaOH溶液,溶液pH变化曲线如图。下列说法错误的是( )
A . a点: B . 导电能力:b<c
C . c点:
B . 导电能力:b<c
C . c点: D . 由d点可得
D . 由d点可得
 B . 导电能力:b<c
C . c点:
B . 导电能力:b<c
C . c点: D . 由d点可得
D . 由d点可得
利用“价类二维图”对元素及其化合物进行相关归纳整理,是一种常用的学习研究方法。硫及其化合物的“价类二维图”如图所示,回答下列问题:

-
(1) M的化学式为,除去
 中少量的
中少量的 杂质可选择的试剂有(填正确答案标号)。
杂质可选择的试剂有(填正确答案标号)。A.饱和
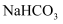 溶液 B.碱石灰 C.饱和
溶液 B.碱石灰 C.饱和 溶液 D.酸性高锰酸钾溶液
溶液 D.酸性高锰酸钾溶液 -
(2) 工业上实现①过程生产
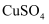 常采用废铜料与稀硫酸在通入空气并加热的条件下反应制取,其反应的离子方程式为。
常采用废铜料与稀硫酸在通入空气并加热的条件下反应制取,其反应的离子方程式为。
-
(3)
 的水溶液中各离子的浓度大小关系是,检验
的水溶液中各离子的浓度大小关系是,检验 溶液是否变质的方法是。
溶液是否变质的方法是。
-
(4) 实验室欲制备
 , 从氧化还原角度分析,下列合理的药品选择是____(填正确答案标号)。
A .
, 从氧化还原角度分析,下列合理的药品选择是____(填正确答案标号)。
A . 和
和 B .
B .  和
和 C .
C .  和S
D .
和S
D .  和
和
-
(5) 已知:常温下
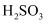 的电离平衡常数
的电离平衡常数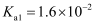 ,
, 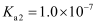 ,
, 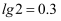 , 忽略第二步电离,则
, 忽略第二步电离,则 溶液的pH约为(保留1位小数)。
溶液的pH约为(保留1位小数)。
最近更新



 溶液,产生沉淀
溶液,产生沉淀 , 产生红褐色沉淀
, 产生红褐色沉淀


