离子浓度大小的比较 知识点题库

-
(1) 在相同浓度的H2SO3和H2CO3的溶液中,用“>”“<”或“=”填空。
c(H+):H2SO3H2CO3;c(SO32-)c(CO32-);
c(H2SO3)c(H2CO3);溶液导电能力:H2SO3H2CO3。
-
(2) HSO3-的电离平衡常数表达式为。
-
(3) H2SO3溶液与NaHCO3溶液反应的主要离子方程式为。



| 溶液 | ①CH3COONa溶液 | ②NaHCO3溶液 | ③CH3COONH4溶液 |
| pH | 8.88 | 8.33 | 7.00 |
下列说法错误的是( )
 的水解程度
C . ③中,c(CH3COO–) = c(NH4+) < 0.1 mol·L–1
D . 推测25oC,0.1 mol·L–1 NH4HCO3溶液的pH <8.33
的水解程度
C . ③中,c(CH3COO–) = c(NH4+) < 0.1 mol·L–1
D . 推测25oC,0.1 mol·L–1 NH4HCO3溶液的pH <8.33
-
(1) 溶液①呈性(填“酸”、“碱”或“中”),其原因是(用离子方程式表示)
-
(2) 在上述①、②、③、④溶液中c(NH4+)浓度由大到小的顺序是。(填序号)
-
(3) 在溶液⑤中,各离子浓度大小顺序为。
-
(4) 室温下,测得溶液②的pH=7,则 CH3COO—与NH4+浓度的大小关系是c(CH3COO—)c(NH4+)(填“>”、“<”或“=”)。
-
(5) 常温下,0.1mol/LCH3COOH溶液加水稀释过程中,下列表达式的数值变大的是____________(填字母)。A . c(H+) B . c(H+)/c(CH3COOH) C . c(H+)·c(OH-) D . c(OH-)/c(H+) E . c(H+)·c(CH3COO-)/c(CH3COOH)
-
(6) 25℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为。
 ) +c(
) +c(  )。室温下用NaOH溶液滴定25.00mL.0. 100mol/L H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
)。室温下用NaOH溶液滴定25.00mL.0. 100mol/L H2C2O4溶液至终点。滴定过程得到的下列溶液中微粒的物质的量浓度关系一定正确的是( )
 )+c(OH-)-c(H2C2O4)
B . c(Na+)=c(总)的溶液:c(Na+)>c(H2C2O4)>c(
)+c(OH-)-c(H2C2O4)
B . c(Na+)=c(总)的溶液:c(Na+)>c(H2C2O4)>c(  )>c(H+)
C . pH=7的溶液:c(Na+)=0.1000mol/L+ c(
)>c(H+)
C . pH=7的溶液:c(Na+)=0.1000mol/L+ c(  )- c(H2C2O4)
D . c(Na+)=2c(总)的溶液:c(OH-)- c(H+)=c(H2C2O4)+c(
)- c(H2C2O4)
D . c(Na+)=2c(总)的溶液:c(OH-)- c(H+)=c(H2C2O4)+c(  )
)
-
(1) ①溶于海水的
 以
以  形式存在。在海洋中,通过如图钙化作用实现碳自净。写出钙化作用的离子方程式。
形式存在。在海洋中,通过如图钙化作用实现碳自净。写出钙化作用的离子方程式。 
②利用氨水作吸收液生成
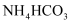 ,是当前有效捕捉
,是当前有效捕捉  的方法之一、下列有关说法错误的是
的方法之一、下列有关说法错误的是A.该方法的优势在于生成的
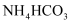 易分解,可实现吸收液的再生
易分解,可实现吸收液的再生B.
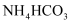 溶液中存在
溶液中存在 
C.
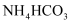 溶液中存在
溶液中存在 
D.已知
 ,可推测
,可推测 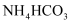 溶液呈酸性
溶液呈酸性 -
(2) 利用反应
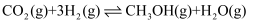
 ,制备重要的化工原料甲醇,在一定条件下进行该反应,测得
,制备重要的化工原料甲醇,在一定条件下进行该反应,测得  的转化率与温度(T)、起始投料比(m)关系如图。
的转化率与温度(T)、起始投料比(m)关系如图。 
①下列描述正确的是。
A.若
 ,则
,则  最大
最大B.在
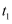 前,
前,  ,在
,在  时,
时, 
C.若
 ,则a点
,则a点  的平衡转化率等于
的平衡转化率等于  的平衡转化率
的平衡转化率D.若反应一段时间后
 和
和  的体积分数相同可判断上述反应达平衡
的体积分数相同可判断上述反应达平衡②图中在
 时,不同的投料比
时,不同的投料比  转化率趋于相近的原因是。
转化率趋于相近的原因是。 -
(3) 以
 、
、  为原料催化重整可得到合成气:
为原料催化重整可得到合成气:  ;
; ①在t℃下,向2L恒容的密闭容器中充入
 和
和  进行催化重整反应,平衡后测得
进行催化重整反应,平衡后测得  和CO的体积分数相等,则t℃下该反应的平衡常数。
和CO的体积分数相等,则t℃下该反应的平衡常数。②催化重整时,催化剂活性会因积碳增多而降低,有关积碳和消碳反应如下:
积碳反应:

消碳反应:

在一定的温度下,增大
 的浓度,有助于增大催化剂活性的原因是。
的浓度,有助于增大催化剂活性的原因是。

下列说法错误的是( )
 B . 酸性废水中的含铅微粒有Pb2+、Pb(OH)+
C .
B . 酸性废水中的含铅微粒有Pb2+、Pb(OH)+
C . 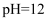 时,溶液中的离子有且仅有
时,溶液中的离子有且仅有  和
和 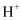 D .
D .  时,除铅效果最好
时,除铅效果最好

 )+c(OH-)=c(H+)+c(H2PO
)+c(OH-)=c(H+)+c(H2PO  )+2c(H3PO4)
C . 当pH=7时,c(Na+)=c(H2PO
)+2c(H3PO4)
C . 当pH=7时,c(Na+)=c(H2PO  )+2c(HPO
)+2c(HPO  )+3c(PO
)+3c(PO  )
D . 当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO
)
D . 当V(NaOH溶液)=20mL时,c(Na+)>c(H2PO  )>c(H3PO4)>c(HPO
)>c(H3PO4)>c(HPO  )
)


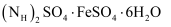 是两种常用原料。
是两种常用原料。
-
(1) 氢叠氮酸易溶于水,25℃时,该酸的电离常数为

①氢叠氮酸在水溶液中的电离方程式为。
②0.1 mol/L的HN3溶液与0.1 mol/L的NaOH溶液等体积混合后,恢复到25℃时溶液中质子守恒关系式为。
③已知T℃时,
 ,
,  , 在此温度下,
, 在此温度下, , 该反应正反应方向(填“能”或“不能”)基本进行彻底,请通过计算说明。
, 该反应正反应方向(填“能”或“不能”)基本进行彻底,请通过计算说明。 -
(2) 在FeSO4溶液中,加入(NH4)2SO4固体可制备莫尔盐晶体,为了测定产品纯度,称取ag产品溶于水,配制成500 mL溶液,用浓度为c mol/L的酸性高锰酸钾溶液滴定,每次所取待测液体积均为25.00 mL,实验结果记录如下(已知莫尔盐的相对分子质量为392):
实验次数
第一次
第二次
第三次
消耗KMnO4溶液体积/mL
25.52
25.02
24.98
滴定终点的现象是,通过实验数据,计算该产品的纯度为(用含字母a、c的式子表示)。上表中第一次实验的记录数据明显大于后两次,其原因可能是(填字母)。
A.第一次滴定时,锥形瓶用待装液润洗
B.该酸性高锰酸钾标准液保存时间过长,部分变质
C.滴定前酸式滴定管中尖嘴处有气泡,滴定结束后气泡消失
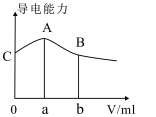
下列说法正确的是( )



