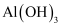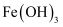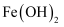难溶电解质的溶解平衡及沉淀转化的本质 知识点题库
-
(1) AgBr固体在水中达到溶解平衡,写出其表达式;此时溶液中c(Ag+)=mol/L;
-
(2) 现向AgBr的悬浊液中:①加入AgNO3固体,则c(Br ﹣)(填“变大”、“变小”或“不变”,下同);
②若改加更多的AgBr固体,则c(Ag+);
③若改加更多的KI固体,则c(Ag+) , c(Br ﹣) .
-
(3) 有关难溶盐的溶度积及溶解度有以下叙述,其中正确的是( )A . 将难溶电解质放入纯水中,溶解达到平衡时,电解质离子的浓度的乘积就是该物质的溶度积 B . 两种难溶盐电解质,其中Ksp小的溶解度也一定小 C . 难溶盐电解质的Ksp与温度有关 D . 向AgCl的悬浊液中加入适量的水,使AgCl再次达到溶解平衡,AgCl的Ksp不变,其溶解度也不变.
-
(1) 冶金工业上常用金属铝作还原剂冶炼钒、铬、锰,铝与V2O5在高温下反应的化学方程式为
-
(2) 将打磨过的铝片在酒精灯火焰上加热,可观察到铝熔化而不滴落,原因是 ;铝是活泼金属,但打磨过的铝片投入沸水中不易观察到有气泡产生.若将铝片用饱和Hg(NO3)2溶液浸泡数分钟,取出后迅速洗净,可制得俗称“铝汞齐”的铝汞合金.铝汞齐露置在空气中,表面会快速生长出蓬松的白毛(Al2O3)口若将新制的铝汞齐放入水中,可迅速反应产生气泡,该反应的化学方程式为 ;铝汞齐的化学性质变得“活泼”的原因可能是
-
(3) 将0.1molL﹣1AlCl3溶液和10%NH4F溶液等体积混合,充分反应后滴加氨水,无沉淀析出.则AlCl3与NH4F反应的化学方程式为 ;该实验所用试管及盛装NH4F溶液的试剂瓶均为塑料材质,原因是
-
(4) 饮用水中的NO3一对人类健康会产生危害.为了降低饮用水中NO3﹣的浓度,有研究人员建议在碱性条件下用铝粉将NO3﹣还原为N2 , 该反应的离子方程式为 ,此方法的缺点是处理后的水中生成了AlO2﹣ , 仍然可能对人类健康产生危害,还需要对该饮用水进行一系列后续处理.
已知25℃时,Ksp[Al(OH)3]=1.3×10﹣33
Al(OH)3⇌AlO
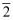 +H﹣+H2O K=1.0×10﹣13
+H﹣+H2O K=1.0×10﹣1325℃时,若欲使上述处理后的水中AlO2﹣浓度降到1.0×10﹣6mol•L﹣1 , 则应调节至pH= ,此时水中c(Al3+)=



-
(1) 酸性溶液中Na2SO3将H2SeO2和H2SeO4还原为硒单质的反应如下:
H2SeO3(aq)+2SO2(g)+H2O(l)=Se(s)+2H2SO4(aq) △H1
2H2SeO4(aq)+Se(s)+H2O(l)=3H2SeO3(aq) △H2
H2SeO4(aq)+3SO2(g)+2H2O(l)=Se(s)+3H2SO4(aq) △H3
则△H2=(用△H1和△H3表示)。
-
(2) H2S与CO2在纳米Cu2O催化作用下反应可生成羰基硫(COS) ,羰基硫的结构式为。
-
(3) 用铜作阳极,钛片作阴极,电解一定浓度的NaCl和NaOH的混合溶液可得到Cu2O,阳极及溶液中物质的有关转化如图1所示,

①阳极的电极反应式为。
②电解一段时间后,向电解液中补充一定量的可将溶液恢复至初始状态。
-
(4) 掺杂硒的纳米Cu2O催化剂可用于工业上合成甲醇:
CO(g)+2H2(g)
 CH3OH(g) △H=akJ·mol-1。
CH3OH(g) △H=akJ·mol-1。按
 =1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
=1的投料比将H2与CO充入VL的恒容密团容器中,在一定条件下发生反应,测得CO的平衡转化率与温度、压强的关系如图2所示。
①a(填“>”或“<”)0;压强p1、p2、p3由小到大的顺序是。
②T1℃时若向该容器中充入2. 0 mol H2和2.0 molCO发生上述反应,5 min后反应达到平衡(M点),则0~5 min内,v(H2)= mol·L-1·min-1 , M点对应条件下反应的平衡常数
为。
-
(5) 将CuCl水解再热分解可得到纳米Cu2O。CuCl 水解的反应为CuC(s) +H2O(l)
 CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=。
CuOH(s)+Cl-(aq)+H+(aq)。该反应的平衡常数K与此温度下Kw、Ksp(CuOH)、Ksp(CuCl)的关系为K=。
已知草酸镍晶体(NiC2O4·2H2O)难溶于水,工业上从废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:

已知:①相关金属离子生成氢氧化物沉淀的pH如下表:
| 金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
| 开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
| 完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10 ③当某物质浓度小于1.0×10-5 mol/L时,视为完全沉淀
-
(1) 请写出一种能提高酸浸速率的措施。
-
(2) 试剂a是一种绿色氧化剂,写出“氧化”时反应的离子方程式。
-
(3) pH的调控范围为 ,滤渣Ⅱ的成分为。
-
(4) 写出“沉镍”时反应的离子方程式,证明Ni2+已经沉淀完全的实验步骤及现象是,当Ca2+沉淀完全时,溶液中c(F-)> mol/L(写出计算式即可)。
-
(5) 操作a的内容是。

已知:① NaClO2的溶解度随温度的升高而增大,适当条件下可结晶析出NaCO2·3H2O。
②KSP(FeS)=6.3×10-18;KSP(CuS)=6.3×10-36;KSP(PbS)=2.4×10-28。
-
(1) 发生器中反应的还原剂是(填化学式,下同),吸收塔中反应的氧化剂是。
-
(2) 亚氯酸钠漂白织物时真正起作用的是HClO2。下表是25℃时HClO2及几种常见弱酸的电离平衡常数。
弱酸
HClO2
HF
HCN
H2S
Ka/mol·L-1
1×10-2
6.3×10-4
4.9×10-10
K1=9.1×108
K2=1.1×10-12
①常温下,物质的量浓度相同的NaF、NaCN两种溶液的pH由大到小的顺序为。
②等体积等物质的量浓度的HClO2与NaOH溶液充分反应后,溶液中各离子浓度由大到小的顺序为 。
③Na2S是常用的沉淀剂。某工业污水中含有等浓度的Cu2+、Fe2+、Pb2+ , 滴加Na2S溶液后最先析出的沉淀是;当最后一种离子沉淀完全时(该离子浓度为10-5 mol·L-1),此时体系中S2-的浓度为 。


 )>c(CO
)>c(CO  )
B . M点对应的溶液中Ba2+、CO
)
B . M点对应的溶液中Ba2+、CO  能形成BaCO3沉淀
C . 相同条件下,SO
能形成BaCO3沉淀
C . 相同条件下,SO  比CO
比CO  更易与Ba2+结合形成沉淀
D . BaSO4不可能转化为BaCO3
更易与Ba2+结合形成沉淀
D . BaSO4不可能转化为BaCO3

回答下列问题:
-
(1) “滤渣1”的主要成分为 Cu(OH)2和(填化学式)。
-
(2) “氧化”时KMnO4的还原产物是MnO2 , 该步骤中除铁、除锰的离子方程式分别为、。
-
(3) “置换”中镉置换率与(
 )的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。
)的关系如图所示,其中Zn的理论用量以溶液中Cd2+的量为依据。 
①实际生产中
 比值最佳为1.3,不宜超过该比值的原因是。
比值最佳为1.3,不宜超过该比值的原因是。②若需置换出112kgCd,且使镉置换率达到98%,实际加入的Zn应为kg。
-
(4) “置换”后滤液溶质主要成分是(填化学式)。
-
(5) “熔炼”时,将海绵镉(含Cd和Zn)与NaOH混合反应,反应的化学方程式是。当反应釜内无明显气泡产生时停止加热,利用Cd与Na2ZnO2的不同,将Cd从反应釜下口放出,以达到分离的目的。
-
(1) 室温时下列指定溶液中微粒物质的量浓度关系正确的是_____ (填字母) .A . 0.1mol·L-1的Na2CO3溶液: c(Na+)+c(H+) =c(OH-)+c(
 )+c(
)+c(  )
B . 0.1mol·L-1的NaHCO3溶液: c(Na+) =c(
)
B . 0.1mol·L-1的NaHCO3溶液: c(Na+) =c(  ) + c(
) + c(  )+ c(H2CO3)
C . 0.1mol·L-1的NaHCO3溶液: c(Na+)>c(
)+ c(H2CO3)
C . 0.1mol·L-1的NaHCO3溶液: c(Na+)>c(  )>c(
)>c(  )>c(H2CO3)
D . 浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液:2c(H+)+c(
)>c(H2CO3)
D . 浓度均为0.1mol·L-1的Na2CO3和NaHCO3混合溶液:2c(H+)+c(  )+3c(H2CO3)=2c(OH-)+c(
)+3c(H2CO3)=2c(OH-)+c(  )
)
-
(2) 水垢中的CaSO4可用Na2CO3溶液处理。当两种沉淀共存时,
 =;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
=;[Ksp(CaCO3) =5.0×10-9、Ksp(CaSO4)=7.0×10-5]
-
(3) 25℃时,碳酸及其盐溶液中含碳元素微粒的分布分数δ随溶液pH变化的关系如图所示。

①纯碱溶液去油污的原理是(用离子方程式表示) 。25℃时,该反应的平衡常数表示为Kh , 则pKh=(pKh=-lgKh)。
②25C时,下列三种溶液
A.0.1mol·L-1的NaHCO3溶液:
B.0.1mol·L-1的Na2CO3溶液:
C.0.1mol·L-1的NaCN溶液。
pH由大到小的顺序为(填字母)。[25℃时,K(HCN)= 10-9.3]
-
(4) NaHCO3可用于铝土矿(主要成分为Al2O3 , 含SiO2和Fe2O3)制铝。流程如下:

①滤渣中除含SiO2转化得到的铝硅酸钠外,还含(填化学式) 。
②写出“沉淀"步骤发生反应的离子方程式和。
| 选项 | 操作 | 现象 | 解释 |
| A | 向某溶液中滴加KSCN溶液 | 产生红色沉淀 | Fe3++3SCN-=Fe(SCN)3↓ |
| B | 向由0.1molCrCl3•6H2O配成的溶液中加入足量AgNO3溶液 | 产生0.2mol沉淀 | 已知Cr3+的配位数为6,则CrCl3•6H2O的化学式可表示为[Cr(H2O)6]Cl3 |
| C | 向溶液K2Cr2O7溶液中先滴加3滴浓硫酸,再改加10滴浓NaOH | 溶液先橙色加深,后又变为黄色 | 溶液中存在Cr2O |
| D | 向Cu(OH)2悬浊液中滴加氨水 | 沉淀溶解 | Cu(OH)2不溶于水,但溶于氨水,重新电离成Cu2+和OH- |
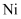 70.0%及一定量的
70.0%及一定量的 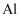 、
、  、
、  和有机物,镍及其化合物的化学性质与铁的类似,但
和有机物,镍及其化合物的化学性质与铁的类似,但 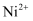 的性质较稳定)。回答下列问题:
的性质较稳定)。回答下列问题: 
已知:部分阳离子以氢氧化物的形式完全沉淀时的  如下表所示。
如下表所示。
| 沉淀物 | | | | |
| | 5.2 | 3.2 | 9.7 | 9.2 |
-
(1) 滤渣a的成分是,用乙醇洗涤废催化剂的目的是,从废液中回收乙醇的方法是
-
(2) 为提高酸浸速率,可采取的措施有(答一条即可)
-
(3) 硫酸酸浸后所得滤液A中可能含有的金属离子是,向其中加入
 的目的是,反应的离子方程式为
的目的是,反应的离子方程式为
-
(4) 利用化学镀(待镀件直接置于含有镀层金属的化合物的溶液中)可以在金属、塑料、陶瓷等物品表面镀上一层金属镍或铬等金属,与电镀相比,化学镀的最大优点是
-
(5) 滤液C进行如下所示处理可以制得
 。滤液C
。滤液C  溶液D
溶液D 
①操作X的名称是
②
 在强碱溶液中用
在强碱溶液中用  氧化,可制得碱性镍镉电池电极材料—
氧化,可制得碱性镍镉电池电极材料—  ,该反应的离子方程式是
,该反应的离子方程式是

已知:Ⅰ.电镀污泥含有Cu(OH)2、Ni(OH)2、Fe(OH)3、Cr(OH)3和SiO2等。
Ⅱ.萃取剂(RH)萃取Ni2+的原理为Ni2++2RH2  NiR2+2H+。
NiR2+2H+。
回答下列问题:
-
(1) “酸浸”时,为加快浸出速率,提高生产效益,下列措施不合理的有___________(填标号)。A . 用机械搅拌器搅拌 B . 体积不变增加硫酸的浓度 C . 进一步球磨粉碎
-
(2) “电解”时,铜的电解电压较低,且电解速率很快,铁和铬存在形式随电解电压的变化如下表。为得到纯的NiSO4·nH2O,电解电压的范围应选择V。
电解电压/V
1.0
1.2
1.5
2.0
2.5
3.0
3.5
Fe2+
有
有
有
无
无
无
无
Cr4+
无
无
无
无
无
有
有
-
(3) 萃取余液可在中循环利用(填操作单元),反萃取剂X为(填化学式)。
-
(4) “反萃取”得到的NiSO4溶液,可在强碱溶液中被NaClO氧化,得到用作镍镉电池正极材料的NiOOH。该反应的离子方程式为。NiSO4溶液经蒸发浓缩、冷却结晶、过滤、洗涤、干燥等多步操作可得NiSO4·nH2O。下列说法正确的是(填标号)。
A.为得到较大NiSO4·nH2O晶体颗粒,宜用冰水快速冷却结晶
B.蒸发浓缩至溶液表面出现晶膜时,停止加热
C.可通过抽滤提高过滤速度,在80℃鼓风干燥,快速得到干燥晶体
D.向冷却结晶后的固液混合物中加入乙醇可提高产率
-
(5) 采用热重分析法测定NiSO4·nH2O样品所含结晶水数。将样品在900℃下进行煅烧,失重率随时间变化如下图,A点时失掉2个结晶水,n的值为;C点产物的化学式为。

-
(1) 开启啤酒瓶后瓶中立刻泛起大量泡沫,该变化(填“能”或“不能”)用勒夏特列原理解释。
-
(2) 如图是碳和水蒸气发生反应生成CO、H2的途径和三个状态的能量,该反应为吸热反应,比较E1、E2、E3的大小:。

-
(3) 某中学开展劳动实习,学生用废电池的锌皮制备ZnSO4∙7H2O,该过程中需除去锌皮中的少量杂质铁,方法是先加稀H2SO4和H2O2溶解,铁变为(填离子符号),再加碱调节至pH为时,铁刚好沉淀完全(离子浓度小于1×10-5mol/L时,即可认为该离子沉淀完全);继续加碱至pH为6时,锌开始沉淀。若上述过程不加H2O2后果是。(已知
 ,lg2
,lg2 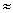 0.3)
0.3) 化合物
Zn(OH)2
Fe(OH)2
Fe(OH)3
Ksp的近似值
10-17
10-17
10-39
-
(1) 碳酸钠和碳酸氢钠是厨房中常用的食品添加剂。根据题意回答下列问题。
①写出酸H2CO3的电离方程式。
②常温下,若将10mL 2 mol∙L−1NaHCO3溶液与10mL 2 mol∙L−1NaOH溶液混合得,则混合溶液中各粒子的浓度关系正确的是(填序号)。
A.

B.

C.

D.

-
(2) 环境问题越来越受到人们的重视,“绿水青山就是金山银山”的理念已被人们认同。研究NOx的处理对缓解环境污染具有重要意义。如实验室可用NaOH溶液吸收NO2 , 反应式为:
 。用含0.2molNaOH的水溶液吸收0.2molNO2恰好完全反应得1L溶液A.溶液B为0.1 mol∙L−1的CH3COONa溶液,则A、B两溶液中
。用含0.2molNaOH的水溶液吸收0.2molNO2恰好完全反应得1L溶液A.溶液B为0.1 mol∙L−1的CH3COONa溶液,则A、B两溶液中 、
、 和c(CH3COO-)由大到小的顺序为(已知HNO2的电离常数
和c(CH3COO-)由大到小的顺序为(已知HNO2的电离常数 , CH3COOH的电离常数
, CH3COOH的电离常数 )。
)。
要使溶液A和溶液B的pH相等,可采用的方法是(填序号)。
a.向溶液A中加适量水 b.向溶液A中加适量NaOH
c.向溶液B中加适量水 d.向溶液B中加适量NaOH
-
(3) 自然界中存在硫的转化。如矿物表层铜的硫化物被氧化为CuSO4 , CuSO4随着雨水渗透到矿物的深层遇到ZnS转化为CuS,写出ZnS转化为CuS的离了反应式。若往20mL1 mol∙L−1Na2S溶液中加入10mL1 mol∙L−1CuSO4溶液,混合后溶液中的Cu2+浓度为 mol∙L−1.(已知
 , 忽略
, 忽略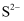 的水解)
的水解)
-
(4) “加氢三分钟,续航700公里”是描述氢氧燃料电池在新能源领域的作用。下图为该电池示意图,在电池电极表面镀了一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答:

①电池的正极反应式为:。
②与火力发电相比,燃料电池的优点是:。

已知:整个工艺流程,溶液中的铬元素均为+3价。
-
(1) 写出酸浸时的离子方程式(至少写2个)。
-
(2) 硫化铬属于难溶电解质,FeS和NiS的溶度积如表所示,试剂a为。将NiS固体加入0.1mol/LFeSO4溶液中,分析是否有FeS生成(简述计算过程,
 ≈5.3)。
≈5.3)。硫化物
Ksp
FeS
6.3×10-18
NiS
2.8×10-21
-
(3) 加入草酸(H2C2O4)生成草酸亚铁的化学方程式。
-
(4) 为满足冶金及颜料级铬绿的要求,氧化铬产品中铁的质量分数应低于0.03%。一种测定氧化铬中铁含量的操作如下:
ⅰ.称取mg氧化铬产品,用酸溶解;
ⅱ.多步操作分离铁和铬;
ⅲ.取含有Fe3+的溶液,调pH,加入指示剂,用cmol/L的无色EDTA—2Na溶液滴定,共消耗EDTA—2Na标准液VmL。
资料:EDTA—2Na和Fe3+按物质的量1:1反应,低浓度时产物无明显颜色。
①指示剂是,滴定终点的现象为。
②氧化铬产品中铁的质量分数是。
 (橙色)+H2O
(橙色)+H2O