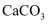常用仪器及其使用 知识点题库
①某试管内装有约占其容积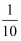 的溶液,则此溶液的体积是(用字母回答)。
的溶液,则此溶液的体积是(用字母回答)。
a.约1 mL b.约3 mL c.无法判断
理由。
②拟在烧杯中于加热条件下配制某溶液50 mL,应选择的烧杯是(用字母回答)。
a.400 mL烧杯 b.250 mL烧杯 c.100 mL烧杯 d.50 mL烧杯
理由。
(1)做过碘升华的容器内壁上粘有碘,用 洗涤;
(2)久置石灰水后的试剂瓶用 洗涤.
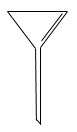
(1)写出图1中序号①~④仪器的名称:

① ;② ; ③ ;④ ;
(2)仪器①~④中,使用时必须检查是否漏水的有 .(填仪器序号)
(3)图2是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL 1mol•L﹣1的稀硫酸.
可供选用的仪器有:
①胶头滴管;②烧瓶;③烧杯;④药匙;⑤量筒;⑥托盘天平.
请回答下列问题:
a.图3中盛放浓硫酸的试剂瓶标签上应印有下列警示标记中的
b.配制稀硫酸时,还缺少的仪器有 、 (写仪器名称);
c.经计算,配制480mL 1mol•L﹣1的稀硫酸需要用量筒量取上述浓硫酸的体积为 mL,量取硫酸时应选用 mL规格的量筒;
A.10mL B.50mL C.100mL D.200mL.
进行下面的实验,必须用到下列何种仪器,请用该仪器的名称填空:

①欲干燥NH3需使用仪器 ;
②欲分离互不相溶的两种液态物质,须使用 ;
③欲分离液态混合物中沸点不同的组分,须使用 ;
④欲分离浮于液体中的固体物质,须使用 .
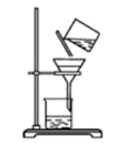
(2)物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节).
①固体和液体的分离 .
②含固体溶质的溶液中除去部分溶剂 .
③几种沸点相差较大的互溶液体的分离 .
④根据两种物质在水中溶解度的不同,提纯物质:
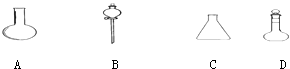
请选择下列仪器名称的序号,填入相应的空格内:
①烧杯 ②普通漏斗 ③圆底烧瓶 ④锥形瓶 ⑤分液漏斗 ⑥容量瓶
ABCD.
 B . 碳酸氢钠受热分解
B . 碳酸氢钠受热分解  C . 除去CO中的CO2气体
C . 除去CO中的CO2气体  D . 乙酸乙酯的制备演示实验
D . 乙酸乙酯的制备演示实验 
反应I:3I2+ 6KOH=KIO3+5KI+3H2O
反应II:3H2S+KIO3=3S↓+KI+3H2O

请回答有关问题。
-
(1) 启普发生器中发生反应的化学方程式为。装置中盛装30%氢氧化钾溶液的仪器名称是。
-
(2) 关闭启普发生器活塞,先滴入30%的KOH溶液,待观察到三颈烧瓶中溶液颜色由棕黄色变为(填现象) ,停止滴入KOH溶液;然后打开启普发生器活塞,通入气体,待三颈烧瓶和烧杯中产生气泡的速率接近相等时停止通气。
-
(3) 滴入硫酸溶液,并对三颈烧瓶中的溶液进行水浴加热,其目的是。接着把三颈烧瓶中的溶液倒入烧杯中,加入碳酸钡,在过滤器中过滤、洗涤。合并滤液和洗涤液,蒸发至析出结晶,干燥得成品。
-
(4) 实验室模拟工业制备KIO3流程如图:

几种物质的溶解度见表:
KCl
KH(IO3)2
KClO3
25℃时的溶解度(g)
20.8
0.8
7.5
80℃时的溶解度(g)
37.1
12.4
16.2
①由上表数据分析可知,“操作a”为。
②用惰性电极电解KI溶液也能制备KIO3 , 请写出电解反应的离子方程式。
-
(5) 某同学测定上述流程生产的KIO3样品的纯度:取1.00g样品溶于蒸馏水中并用硫酸酸化,再加入过量的KI和少量的淀粉溶液,逐滴滴加2.0mol·L-1Na2S2O3溶液,恰好完全反应时共消耗12.60mLNa2S2O3溶液。该样品中KIO3的质量分数为。(已知反应:I2+2Na2S2O3=2NaI+Na2S4O6)。
| 提取碘水中的碘 | 量取一定体积的KMnO4溶液 | 熔化NaOH固体 | 浓缩NaCl溶液 |
| | | | |
| A | B | C | D |
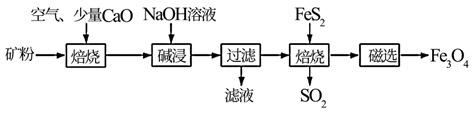
已知矿粉焙烧过程中FeS2与O2反应生成Fe2O3和SO2
-
(1) 工业上为了加快“碱浸速率,可采取的措施有:(任写2点);
“碱浸”时涉及硅元素的化学反应方程式为:。
-
(2) 向“过滤”得到的滤液中通入过量CO2后,铝元素存在的形式为化学式(填化学式)。“过滤”操作需要用到的玻璃仪器有:烧杯、、。
-
(3) “过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2 , “焙烧”过程理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=。
-
(4) 添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如图所示。
已知:多数金属硫酸盐的分解温度都高于600℃硫去除率=(1-
 )×100%
)×100%
700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是。
 B .
B .  C .
C .  D .
D . 
序号 | 操作及现象 | 结论 |
A | 将 | 稀释后, |
B | 向 | 温度升高, |
C | 常温下,测得饱和 | 常温下水解程度: |
D | 将固体 | 同温度下溶解度: |

回答下列问题:
-
(1) 分液漏斗使用前必须进行的操作为,欲使分液漏斗内的浓盐酸顺利滴下,可将分液漏斗上部的玻璃塞打开或。
-
(2) 装置的正确连接顺序是(按气流方向,用小写字母表示)。
-
(3) 装置C中发生Cl2O的制备反应中的固体产物为NaHCO3和NaCl,写出该反应的化学方程式。反应一段时间后,装置B中观察到的实验现象为。
-
(4) 研究表明,装置B中Cl2O的收率与装置C的温度和纯碱的含水量的关系如下表所示:
温度/℃
纯碱中含水量/%
Cl2O的收率/%
0~10
5.44
67.85
0~10
7.88
89.26
10~20
8.00
64.24
30~40
10.25
52.63
30~40
12.50
30.38
本实验中适宜选用的温度范围和纯碱的含水量分别为、。
-
(5) 装置F中盛放碱石灰的仪器名称为,碱石灰的作用为。
-
(6) 若将少量Cl2O气体通入用稀硫酸酸化的KI-淀粉溶液中,溶液会变蓝色,溶液变蓝色的原因为(用离子方程式表示)。
 和
和 , 探究其氧化还原性质。
, 探究其氧化还原性质。已知:① 是一种无色、密度比水大、不溶于水的液体。
是一种无色、密度比水大、不溶于水的液体。
②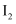 的水溶液呈棕黄色,
的水溶液呈棕黄色,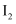 的
的 溶液呈紫色。
溶液呈紫色。

回答下列问题:
-
(1) 盛放浓盐酸的仪器名称是,a中的试剂为。
-
(2) b中采用的加热方式是,c中反应的离子方程式是。
-
(3) 当观察到c中(填实验现象)时,可判定
 将试管中的
将试管中的 溶液反应完。
溶液反应完。
-
(4) d的作用是。
-
(5) 反应结束后,取出b中试管,经冷却结晶,,少量冷水洗涤,干燥,得到
 晶体。
晶体。
-
(6) 取少量
 和
和 溶液分别置于1号和2号试管中,滴加中性
溶液分别置于1号和2号试管中,滴加中性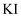 溶液。1号试管溶液颜色不变。2号试管溶液变为棕黄色,加入
溶液。1号试管溶液颜色不变。2号试管溶液变为棕黄色,加入 振荡,静置后
振荡,静置后 层显紫色。可知该条件下
层显紫色。可知该条件下 的氧化能力
的氧化能力 (填“大于”或“小于”)。
(填“大于”或“小于”)。
 氨水稀释成
氨水稀释成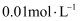 测得
测得 由11.1变成10.6
由11.1变成10.6 的电离程度减小
的电离程度减小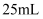 冷水和沸水中分别滴入5滴
冷水和沸水中分别滴入5滴 饱和溶液,前者为黄色,后者为红褐色
饱和溶液,前者为黄色,后者为红褐色 的水解程度增大
的水解程度增大 溶液的
溶液的 溶液
溶液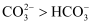
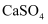 加入
加入