常用仪器及其使用 知识点题库
(1)做过碘升华实验的烧杯 .
(2)长期存放过三氯化铁溶液的试剂瓶 .
(3)盛过苯酚的容器
![]()

-
(1) 其中能够直接加热的是(填序号):;
-
(2) 仪器①在加热固体时,试管口应;
仪器③在蒸发实验中,所加液体体积不超过容积的
①试管 ②集气瓶 ③蒸犮皿 ④量筒 ⑤烧杯 ⑥燃烧匙
主反应:CH3COOH+C2H5OH  CH3COOC2H5+H2O
CH3COOC2H5+H2O
副反应:2CH3CH2OH  CH3CH2OCH2CH3(乙醚)+H2O
CH3CH2OCH2CH3(乙醚)+H2O
CH3CH2OH  CH2=CH2↑+H2O
CH2=CH2↑+H2O
根据查得的资料设计了下图所示的装置(夹持装置忽略)制取纯净的乙酸乙酯。

步骤如下:
①在图1的三口烧瓶中加入3mL乙醇,边摇动边慢慢加入3mL浓硫酸,在分液漏斗中装入3:2的乙醇和乙酸混合液。
②油浴加热三口烧瓶至一定温度,然后把分液漏斗中的混合液慢慢地滴入三口烧瓶里并保持反应混合物在一定温度。
③反应一段时间后,向锥形瓶中缓慢加入饱和Na2CO3溶液,并不断摇动,分层后进行分液。
④用饱和食盐水和氯化钙溶液洗涤酯层,再分液,在酯层加入干燥剂干燥得粗乙酸乙酯。
⑤将粗乙酸乙酯转入图2的仪器A中,在水浴中加热,收集74~80℃的馏分即得纯净的水果香味无色透明液体。
根掲题目要求回答:
-
(1) 在实验中浓硫酸的作用;混合液加热前都要加入碎瓷片,作用是。
-
(2) 歩驟②中油浴加热保持的一定温度范围,原因是。
-
(3) 图2中仪器A的名称是,冷凝管中冷水从(填a或b)口进入。
-
(4) 步骤③和④中都用到了分液操作,该操作用到的主要玻璃仪器是,在分液操作时,上下两层液体移出的方法是。
-
(5) 步骤④中干燥乙酸乙酯,可选用的干燥剂为(填字母)。
a.五氧化二磷
b.无水Na2SO4
c.碱石灰
-
(1) 有①分液漏斗②量筒③容量瓶,使用前需检查是否漏液的是(填序号)
-
(2) molH2O中含有的氧原子数与1.5molCO2中含有的氧原子数相等。
-
(3) 标准状况下的四种气体:①6.72LCH4②3.01×1023个HCl分子③13.6gH2S④0.2molNH3 , 密度最大的是(填序号)
-
(4) 10mL的CaCl2溶液里含2gCa2+ , 从中取出一半的溶液中Cl-的物质的量浓度是。
-
(5) 在Na2SO4和K2SO4的混合溶液中c(Na+)=0.2mol/L,c(SO42-)= amol/L,c(K+)=bmol/L时,a和b的关系是。
-
(6) 某物质A加热时按化学方程式2A=2B+C+3D分解,产物均为气体,测得由生成物组成的混合气体对H2的相对密度为20,则反应物A的摩尔质量为。
-
(7) 下列物质中:①铜 ②碳酸钙 ③氨气 ④氯气 ⑤空气 ⑥二氧化碳 ⑦氯化钠晶体 ⑧熔融硫酸钠。
属于电解质的是, 非电解质的是。

-
(1) 仪器B的名称为,由仪器B的使用可知SO2与Cl2反应的ΔH(填“>”或“<”)0。
-
(2) 仪器C的作用是。
-
(3) 试剂X、Y的组合最适宜的是。
a.18.4mol/LH2SO4溶液+Cu b.4mol/LHNO3溶液+Na2SO3 c.75%H2SO4溶液+K2SO3
-
(4) 反应结束后,将丙中产物分离的实验操作的名称是。
-
(5) 分离产物后,向获得的SO2Cl2中加入足量NaOH溶液,振荡、静置得到无色溶液w。
①写出该反应的离子方程式:。
②检验溶液w中存在SO42-的方法是。
-
(6) 若反应中消耗的氯气的体积为896 mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氯3.3 g,则磺酰氯的产率为(保留三位有效数字)。
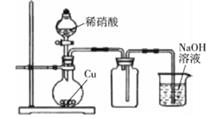 实验室制备少量NO
B .
实验室制备少量NO
B . 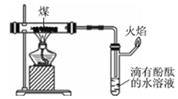 煤的干馏并验证部分产物
C .
煤的干馏并验证部分产物
C .  探究乙醇的催化氧化
D .
探究乙醇的催化氧化
D . 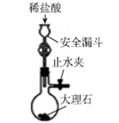 实验室制备少量CO2
实验室制备少量CO2
-
(1) I.铅能形成多种氧化物,如碱性氧化物PbO、酸性氧化的PbO2、还有组成类似Fe3O4的Pb3O4 ,请将Pb3O4 改写成简单氧化物的形式: 。
-
(2) II.以废旧铅酸电池中的含铅废料铅膏(Pb、PbO 、PbO2、PbSO4等)为原料,制备超细PbO ,实现铅的再生利用。其工作流程如下:
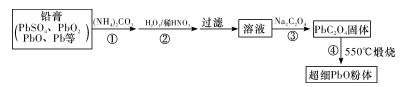
步骤① 的目的是“脱硫”,即将PbSO4转化PbSO3 , 反应的离子方程式为。
“脱硫过程”可在如图所示的装置中进行,实验条件为:转化温度为35℃,液固比为5:1,转化时间为2h。
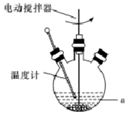
①仪器a的名称是 ;转化温度为35 ℃, 采用的合适加热方式是。
②步骤②中H2O2的作用是 (用化学方程式表示)。
-
(3) 草酸铅受热分解生成PbO时,还有CO和CO2生成,为检验这两种气体,用下图所示装置(可重复选用)进行实验。实验装置中,依次连接的合理顺序为A (填装置字母代号),证明产物中有CO气体的实验现象是。

-
(4) 测定草酸铅样品纯度:称取2.5g样品,酸溶后配制成250mL溶液,然后量取25.00mL该溶液,用0.05000mol•L-1的EDTA(Na2H2Y)标准溶液滴定其中的Pb2+ (反应方程式为Pb2++H2Y2-= PbY2- +2H+ , 杂质不反应),平行滴定三次,平均消耗EDTA标准溶液14.52mL
①若滴定管未用 EDT A 标准液润洗,测定结果将 (填“偏高” “偏低” 或“不变”)。
②草酸铅的纯度为 (保留四位有效数字)。

-
(1) A装置中装浓盐酸的仪器名称为。
-
(2) B装置的作用为,C装置中的试剂是(填名称)。
-
(3) 实验结束后,D装置中生成了固体氯化氨基汞,请写出D装置中生成氯化氨基汞反应的化学方程式:。D装置采用长短不同的导管的原因是。
-
(4) E装置中装入的固体可以是__(填字母)。A . CaO B . 碱石灰 C . P2O5 D . CaCl2
-
(5) 该实验的不足之处是。
-
(6) 样品中氯化氨基汞的含量测定:称取0.55g样品,加入水及稀硫酸溶解,向溶解后的溶液中加入0.1mol·L-1的KI溶液,立即出现橙红色沉淀,继续滴加KI溶液至沉淀消失,溶液呈无色[已知:Hg2++2I-=HgI2↓(橙红色),HgI2+2I-=HgI
 (无色)],共消耗80.00mLKI溶液。则样品中氯化氨基汞的质量分数为__(保留三位有效数字)。
(无色)],共消耗80.00mLKI溶液。则样品中氯化氨基汞的质量分数为__(保留三位有效数字)。

回答下列问题:
-
(1) 试剂a最好选用的试剂是______________(填选项字母);A . HCl溶液 B . 浓H2SO4 C . H2O2溶液 D . FeCl3和HCl混合液
-
(2) 辉铋矿的浸出液中铋元素主要以Bi3+形式存在,写出浸出过程生成S渣的离子方程式,“滤液b”中通入气体X后可循环利用,气体X是 (写化学式);
-
(3) “抽滤”用如下装置完成,请选择字母代号补全正确的操作顺序(洗涤操作只做一次):

开抽气泵→a→b→d→ →c→ 关抽气泵;
a.转移固液混合物 b.关活塞A c.开活塞A d.确认抽干 e.加洗涤剂洗涤
-
(4) 写出“煅烧”碱式碳酸铋[(BiO)2CO3]制备Bi2O3 的化学方程式;
-
(5) 硝酸酸溶后调pH可得到碱式硝酸铋,碱式硝酸铋直接灼烧也能得到Bi2O3 , 上述工艺中却转化为碱式碳酸铋再灼烧,除了能改良产品性状,另一优点是;
-
(6) 从“母液”中回收可用做炸药的物质是 ( 写物质名称)。

-
(1) “焙烧还原”时ZnCO3被(填“氧化”“还原”),写出CuCO3转化为Cu的化学方程式并用双线桥法表示电子转移情况:。
-
(2) 酸X的化学式为。
-
(3) 酸浸时用到的4.5mol·L-1的X溶液需用18mol·L-1的X浓溶液配制。
①配制90mL4.5 mol·L-1X溶液需要用到的玻璃仪器有量筒、烧杯、胶头滴管、玻璃棒、,需量取mL18mol·L-1X浓溶液。
②下列操作使所配溶液浓度偏大的是(填字母)。

 俗名“大苏打”,是无色透明晶体,不溶于乙醇,易溶于水,在
俗名“大苏打”,是无色透明晶体,不溶于乙醇,易溶于水,在 和
和 时的溶解度分别为
时的溶解度分别为 和212g。实验室常用
和212g。实验室常用 与
与 、
、 共热制备
共热制备 , 某兴趣小组拟用如下实验装置制备硫代硫酸钠。回答下列问题:
, 某兴趣小组拟用如下实验装置制备硫代硫酸钠。回答下列问题:
-
(1)
 属于
属于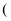 填“纯净物”或“混合物”
填“纯净物”或“混合物”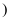 , 仪器a的名称。
, 仪器a的名称。
-
(2) 装置B中盛放的试剂是饱和
 溶液,下列属于装置B作用的是____。
A . 除去
溶液,下列属于装置B作用的是____。
A . 除去 中混有的
中混有的 B . 观察
B . 观察 的生成速率
C . 用于观察装置否堵塞
D . 用于除去A装置中挥发出的
的生成速率
C . 用于观察装置否堵塞
D . 用于除去A装置中挥发出的 4
4
-
(3) 在装置C中制备硫代硫酸钠时,有气体生成,写出该反应的化学方程式:。
-
(4)
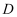 装置用于检验C中
装置用于检验C中 的吸收效率进而调整
的吸收效率进而调整 的流速,则D中盛装的试剂可以为
的流速,则D中盛装的试剂可以为 填写一种即可
填写一种即可 。
。
-
(5) 待反应结束后,从C中溶液获得
 的方法是:、、过滤、洗涤、干燥。其中洗涤时应选用做洗涤剂。
的方法是:、、过滤、洗涤、干燥。其中洗涤时应选用做洗涤剂。
-
(6) 测定粗产品中
 的含量。称取
的含量。称取 粗产品溶于水,用
粗产品溶于水,用 酸性
酸性 溶液进行滴定
溶液进行滴定 假设杂质不与酸性
假设杂质不与酸性 溶液反应
溶液反应 , 当溶液中
, 当溶液中 全部被氧化为
全部被氧化为 达到滴定终点时,消耗高锰酸钾溶液40.00mL。则滴定达到终点时的现象是;产品中
达到滴定终点时,消耗高锰酸钾溶液40.00mL。则滴定达到终点时的现象是;产品中 的质量分数为
的质量分数为 保留小数点后一位
保留小数点后一位 。
。

-
(1) 装置A种盛放浓盐酸的玻璃仪器的名称是。
-
(2) A中利用浓盐酸和MnO2固体的反应制备氯气,反应的化学反应方程式是。
-
(3) 验证氯气的氧化性强于碘的实验现象是。
-
(4) B中溶液发生反应的离子方程式是。
-
(5) B中浸有NaOH溶液的棉花的作用是什么。
 B .
B .  C .
C .  D .
D . 



