制取氢氧化铁、氢氧化亚铁 知识点题库

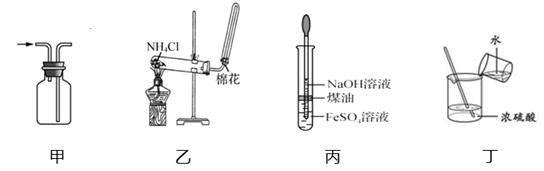
(1)在试管Ⅰ里加入的试剂是 .
(2)Ⅱ中的试剂加入前应如何处理: .
(3)为了制得白色Fe(OH)2沉淀,在试管I和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .

(1)在试管Ⅰ里加入的试剂是 .
(2)在试管Ⅱ里加入的试剂是 .
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是 .
(4)为何能在较长时间内观察到Fe(OH)2白色沉淀: .
综上所述,关于Fe(OH)2制备的改进方法很多,核心问题有两点:一是溶液中的溶解 ;二是反应过程必须 .

-
(1) Al(OH)3 与氢氧化钠溶液反应:
-
(2) 氢氧化亚铁被氧化成氢氧化铁:
-
(3) 二氧化硅与氢氟酸反应:
-
(4) 氨气的实验室制取法:
-
(5) 浓硫酸与木炭反应:
-
(6) 稀硝酸与铜反应:.
-
(1) 氢氧化亚铁放置于空气中,颜色发生改变,有关化学方程式:;
-
(2) 小苏打溶于水,其电离方程式:;
-
(3) 铁红中铁的化合价为:,它与盐酸反应的离子方程式为;
-
(4) 明矾[KAl(SO4)2•12H2O]能净水是由于其溶于水后生成了(写化学式);
-
(5) 工业上制取漂白液,有关离子方程式并用双线桥标明电子得失:.
 ,该厂用上述废金属屑制取新型高效水处理剂
,该厂用上述废金属屑制取新型高效水处理剂  (高铁酸钠)等产品,过程如下:
(高铁酸钠)等产品,过程如下: I. 向废金属屑中加入稀  ,充分反应后,剩余两种固体单质和溶液;
,充分反应后,剩余两种固体单质和溶液;
II. 向I所得固体中继续加入足量稀  ,过滤后,向所得固体中加入硫酸酸化的
,过滤后,向所得固体中加入硫酸酸化的  ,固体溶解得
,固体溶解得  溶液;
溶液;
III. ……
-
(1) 步骤I所得溶液中加入KSCN溶液无明显现象,用离子方程式解释其可能的原因。步骤I所得溶液中滴加NaOH溶液,看到的现象是,涉及的化学反应方程式是、。向I所得固、液混合物中通入过量氯气,并不断搅拌,充分反应后,溶液中的金属阳离子是(填写离子符号)。
-
(2) 步骤II中
 在酸性条件下氧化了铜,获得
在酸性条件下氧化了铜,获得  溶液。参加反应的
溶液。参加反应的  与Cu的物质的量之比为。
与Cu的物质的量之比为。
-
(3) 步骤I所得溶液经进一步处理可制得
 ,流程如下:
,流程如下: 
写出由
 制取
制取  的离子反应方程式。
的离子反应方程式。
-
(1) 现将少量Fe2O3粉末加入适量稀盐酸,发生反应的离子方程式,用所得溶液进行以下实验:
-
(2) 取少量溶液于试管中,滴入NaOH溶液,观察到有红褐色沉淀生成,反应的离子方程式为。
-
(3) 取少量溶液于试管中,加入少量还原铁粉,振荡,铁粉逐渐溶解,溶液由黄色变为浅绿色,反应的离子方程式为。
-
(4) 在烧杯中加入25mL蒸馏水,加热至沸腾,向沸水中滴加几滴FeCl3饱和溶液,继续煮沸直到溶液呈红褐色,即得到Fe(OH)3胶体。取少量Fe(OH)3胶体,逐滴加入盐酸至过量,可观察到的现象是:先,然后,对后一现象的解释是(用离子方程式表示)。

-
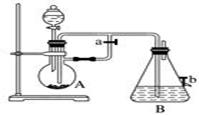
(1) B中盛一定量的NaOH溶液,A中应预先加入的试剂是,A中反应的离子方程式是。
-
(2) 实验开始时就先将活塞E(填“打开”或“关闭”),C中收集到气体的主要成分是。
-
(3) 简述生成Fe(OH)2的操作过程。
-
(4) 拔去装置B中的橡皮塞,使空气进入,装置B中发生的现象为 。
填写下列空白:
-
(1) B中盛有一定量的NaOH溶液,A中应预先加入的是,A中反应的离子方程式是。
-
(2) 实验开始时应先将活塞a打开,其目的是。
-
(3) 简述生成Fe(OH)2的操作过程:
-
(4) 实验完毕,打开b处活塞,放入一部分空气,此时B中发生反应的化学方程式为。
-
(5) 图中(填“能”或“不能”)较长时间看到Fe(OH)2白色沉淀。

回答下列问题:
-
(1) 步骤②滴加过量6%H2O2 , 生成红褐色胶状沉淀,该反应的化学方程式为。生成的沉淀不易过滤,过滤前需要的操作是。
-
(2) 步骤③将Fe(OH)3加入到KHC2O4溶液中,水浴加热,控制pH为3.5-4,若pH偏高应加入适量(填“H2C2O4”或“K2C2O4”)。
-
(3) 步骤④的操作是、过滤。得到的晶体依次用少量冰水、95%乙醇洗涤,用95%乙醇洗涤的目的是。
-
(4) 测定K3[Fe(C2O4)3]·3H2O中铁的含量。
①称量mg样品于锥形瓶中,溶解后加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点。滴定反应的氧化产物为。滴定时,盛放高锰酸钾溶液的仪器是(“酸式”或“碱式”)滴定管。
②向上述溶液中加入过量锌粉至将铁元素全部还原为Fe2+后,过滤、洗涤,将滤液及洗涤液全部收集到锥形瓶中。加稀H2SO4酸化,用cmol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。该样品中铁的质量分数的表达式为。
I、甲同学向氯化铁溶液中加入少量的NaOH溶液;
II、乙同学向沸水中滴加饱和氯化铁溶液后,长时间加热;
III、丙同学向25 ml沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
-
(1) 其中操作正确的同学是;他的操作中涉及到的制备胶体的离子反应方程式为。
-
(2) 判断胶体制备是否成功,可利用胶体的。
-
(3) 丁同学将所制得的Fe(OH)3胶体分成两份,并进行下列实验:
①将其中一份装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明。
②向另一份Fe(OH)3胶体中逐滴加入了稀H2SO4溶液,结果出现了一系列变化。
a. 先出现红褐色沉淀,原因是。
b. 随后沉淀溶解,此反应的离子方程式是。
-
(1) 已知有毒胶囊中含有Fe(CrO2)2 , 其中铬元素是+3价,则其中铁元素的化合价为。
-
(2) 区别明胶水溶液和Na2SO4溶液的方法是。
-
(3) 将饱和FeCl3溶液分别滴入下述液体中,也能形成胶体的是____________。A . 冷水 B . 沸水 C . NaCl溶液 D . NaOH溶液
-
(4) 已知胶体的分散质不能透过半透膜,但小分子或离子能透过半透膜。现将10mL明胶水溶液与5mLNa2SO4溶液混合后装入半透膜内,将此半透膜袋浸入盛蒸馏水的烧杯中。写出能证明Na+透过半透膜的实验方法(具体操作):。

-
(1) 本实验中为制得氢氧化亚铁如何保证无氧条件。
-
(2) 在将硫酸亚铁压入制得氢氧化亚铁的操作之前必须要进行的操作是。
①向沸水中逐滴加入少量饱和  溶液,可制得
溶液,可制得 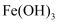 胶体
胶体
②用pH试纸测得氯水的 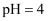
③除去  气体中的
气体中的  ,可将气体通入饱和食盐水中
,可将气体通入饱和食盐水中
④  能与
能与  溶液、
溶液、 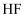 溶液反应,所以
溶液反应,所以  是两性氧化物
是两性氧化物
⑤铅酸蓄电池放电时的正极电极反应为 
⑥由  可推出
可推出 
-
(1) 写出生成此溶液所发生反应的化学方程式为。
-
(2) 取少量该FeCl3溶液置于试管甲中,滴入NaOH溶液,可以观察到有红褐色沉淀生成,反应的化学方程式为,此反应属于(填基本反应类型)。
-
(3) 在小烧杯甲中加入25 mL蒸馏水,加热至沸腾后,向中逐滴加入,继续煮沸至溶液呈色,即可制得Fe(OH)3胶体 。
-
(4) 判断Fe(OH)3胶体制备是否成功,可利用胶体的性质检验。制备得到的Fe(OH)3胶体是不是电解质:(填“是”或“不是”)。

-
(1) 同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
-
(2) 同学乙:打开a,使A管中反应一段时间再 夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为 。
-
(3) 同学乙打开a的目的 ;(填甲或乙)同学可成功。
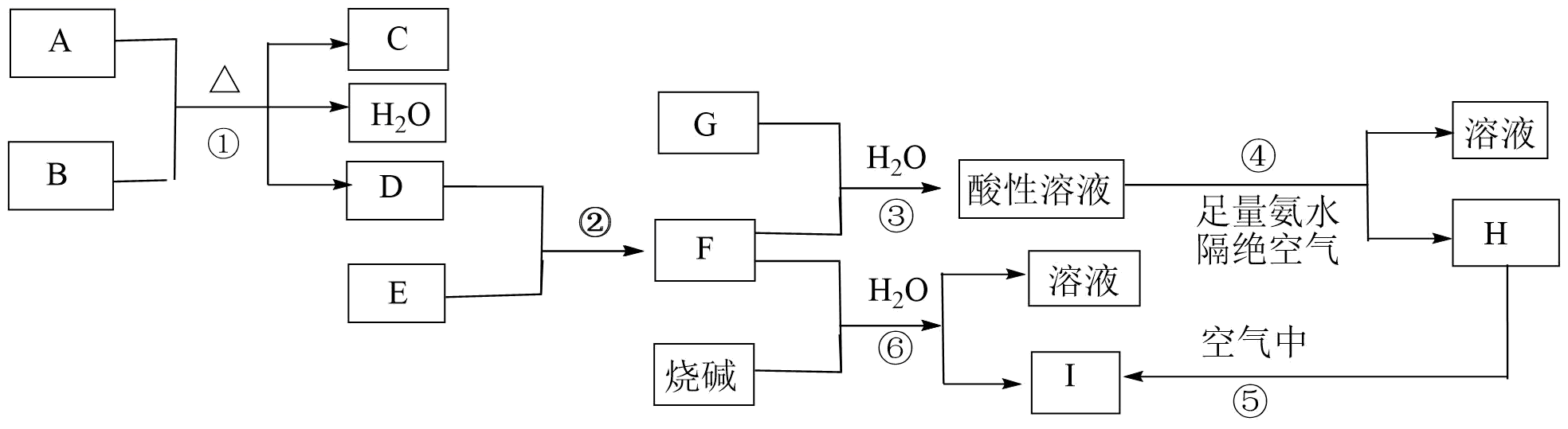
请回答下列问题:
-
(1) 推断出下列物质(用化学式作答):C,G。
-
(2) 请写出下列反应的方程式:反应①的离子方程式;反应③的离子方程式;反应⑤的化学方程式。
-
(3) 欲从反应⑥的体系中得到沉淀I的系列操作是、、恒温干燥(均填操作名称)。
-
(4) 实验室配制90 mL2 mol/L的烧碱溶液,需选用mL容量瓶。用托盘天平称取g烧碱。若定容时,俯视刻度线,配制的溶液的浓度(填“偏大”“偏小”或“无影响”)。