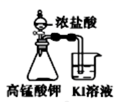
制取氢氧化铁、氢氧化亚铁 知识点题库
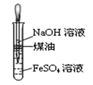
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是 ,A中反应的离子方程式是 .
(2)实验开始时就先将活塞E (填“打开”或“关闭”),C中收集到气体的主要成分是 .
(3)简述生成Fe(OH)2的操作过程 .
(4)拔去装置B中的橡皮塞,使空气进入,预期观察到的现象是: .
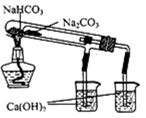
(1)B中盛一定量的NaOH溶液,A中应预先加入的试剂是 ,A中反应的离子方程式是: .
(2)实验开始时就先将活塞E (填“打开”或“关闭”),C中收集到气体的主要成分是 .
(3)简述生成Fe(OH)2的操作过程 .
(4)拔去装置B中的橡皮塞,使空气进入,写出有关反应的化学方程式: .
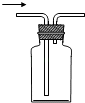 作为安全瓶防止倒吸
B .
作为安全瓶防止倒吸
B .  喷泉实验
C .
喷泉实验
C . 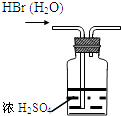 干燥HBr
D .
干燥HBr
D . 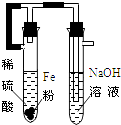 制取Fe(OH)2
制取Fe(OH)2
-
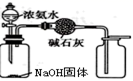
(1) Fe(OH)2在空气中变质的化学方程为:。
-
(2) 漂白粉在空气中久置会变质,变质过程中既有非氧化还原反应又有氧化还原反应,其中氧化还原反应的方程式为:。
-
(3) 实验室制备氨气的反应方程式为:,收集氨气时,在试管口放一小团棉花其作用是,用试纸检验氨气是否收集满。
-
(4) 将CaMg3Si4O12改写为氧化物的形式:。
-
(1) 原电池反应通常是放热反应,下列反应中在理论上可设计成原电池的反应为(填字母), 理由是。
A.C(s)+H2O(g)=CO(g)+H2(g) △H>0
B.Ba(OH)2·8H2O(s)+2NH4Cl(s)=BaCl2(aq)+2NH3·H2O(aq)+8H2O(l) △H>0
C.CaC2(s)+2H2O(l)=Ca(OH)2(s)+C2H2(g) △H <0
D.CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H <0
-
(2) 以KOH溶液为电解质溶液,依据(1)所选反应设计原电池,其负极反应为。
-
(3) 电解原理在化学工业中有着广泛的应用,现将设计的原电池通过导线与图中电解池相连,其中a为电解液,X和Y为两块电极板,则:
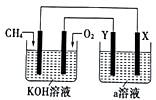
①若X和Y均为惰性电极,a为饱和NaCl溶液,则电解时检验Y电极反应产物的方法是。
②若X和Y分别为石墨和铁,a仍为饱和NaCl溶液,则电解过程中生成的白色固体物质露置在空气中,可观察到的现象是。
③若X和Y均为惰性电极,a为一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.1 molCuO,恰好恢复电解前的浓度和pH,则电解过程中转移的电子的物质的量为。
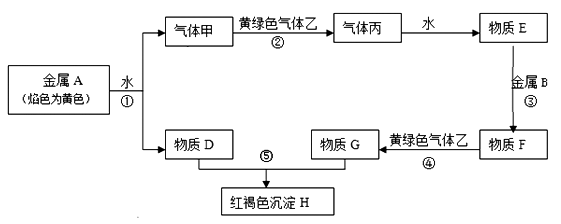
请回答下列问题:
-
(1) 丙的化学式是。
-
(2) 写出下列反应的化学方程式,是离子反应的写离子方程式:
反应①;反应②;反应⑤。
-
(3) 将0.4gD和1.06g
 混合并配成溶液,向溶液中滴加0.1
混合并配成溶液,向溶液中滴加0.1 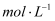 稀盐酸。在下面坐标系中画出能正确表示加入盐酸的体积和生成
稀盐酸。在下面坐标系中画出能正确表示加入盐酸的体积和生成 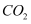 的物质的量的关系图像。
的物质的量的关系图像。 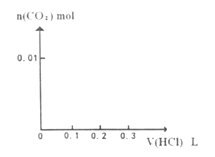

请回答:
-
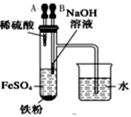
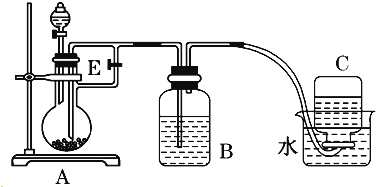
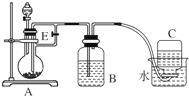
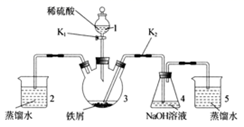
(1) 仪器1的名称。装置5的作用。
-
(2) 实验开始时,关闭K2 , 打开K1 , 反应一段时间后,再打开K2 , 关闭K1 , 发现3中溶液不能进入4中。请为装置作一处改进,使溶液能进入4中。
-
(3) 装置改进后,将3中反应后溶液压入4中,在4中析出了灰绿色沉淀。从实验操作过程分析没有产生白色沉淀的原因。
-
(1) 向Fe(OH)3胶体中逐滴滴入过量的盐酸,会出现一系列变化:先出现,随后,原因(用离子方程式和适当的文字表示)
-
(2) 实验室用饱和溶液制取Fe(OH)3 胶体的实验操作过程是 。现有NaCl溶液和Fe(OH)3 胶体的混合体系,若要除去 Fe(OH)3 胶体,可以采用的操作是,若要除去体系中的Na+ 和Cl- , 可以采用的方法。
|
选项 |
A |
B |
C |
D |
|
操作 |
|
|
|
|
|
目的 |
制取氢氧化亚铁并观察其颜色 |
制备无水氯化镁 |
比较两种物质的热稳定性 |
制取收集干燥纯净NH3 |
①“卤水点豆腐”“黄河入海口处三角洲的形成”都与胶体的聚沉有关
②提纯 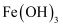 胶体,可以采用的方法是过滤
胶体,可以采用的方法是过滤
③明矾能作净水剂是因为铝离子与水作用生成的氢氧化铝胶体具有吸附悬浮杂质的作用
④在制备 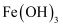 胶体实验中,可以长时间加热
胶体实验中,可以长时间加热
⑤向 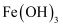 胶体中加入过量稀硫酸,先有红褐色沉淀生成,然后沉淀溶解形成棕黄色溶液
胶体中加入过量稀硫酸,先有红褐色沉淀生成,然后沉淀溶解形成棕黄色溶液
|
选项 |
实 验 |
现 象 |
|
A |
向氢氧化钠溶液中滴加FeCl3饱和溶液 |
有氢氧化铁胶体产生 |
|
B |
在酒精灯上加热铝箔 |
铝箔熔化,失去光泽,熔化的铝滴落下来 |
|
C |
向滴有酚酞的溶液中加入足量Na2O2粉末 |
溶液变红 |
|
D |
加热放在坩埚中的小块钠 |
钠先熔化成光亮的小球,燃烧时火焰为黄色,燃烧后生成淡黄色固体 |
请填写下列空白:
-
(1) 仪器1的名称是。装置5的作用是。
-
(2) 实验开始时,关闭K2、打开K1 , 反应一段时间后,再打开K2、关闭K1 , 发现装置3中溶液不能进入装置4中。请改进装置,使溶液能进入装置4中:。
-
(3) 装置改进后,将装置3中反应后溶液压入装置4中,在装置4中立即析出白色絮状沉淀,迅速变为灰绿色,最终变为红褐色。请写出装置4中涉及到的化学方程式、,若始终没有观察到白色沉淀,从实验操作过程分析可能的原因是。
| 目的 | 操作 | |
| A | Cu与浓硫酸反应后未见溶液变蓝色,为了观察生成了CuSO4 | 向反应后的溶液中加入适量蒸馏水 |
| B | 清洗碘升华实验所用试管 | 先用酒精清洗,再用水清洗 |
| C | 检验某溶液中是否有SO42﹣ | 取少量溶液于试管中,向该溶液中加入已用盐酸酸化的BaCl2溶液 |
| D | 制备Fe(OH)3胶体 | 将NaOH溶液滴加到饱和FeCl3溶液中 |
| 实验目的 | 玻璃仪器 | 试剂 | |
| A | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
| B | 制备Fe(OH)3胶体 | 烧杯、酒精灯、胶头滴管 | 蒸馏水、饱和FeCl3溶液 |
| C | 测定NaOH溶液浓度 | 烧杯、锥形瓶、胶头滴管、酸式滴定管 | 待测NaOH溶液、已知浓度的盐酸、甲基橙试剂 |
| D | 制备乙酸乙酯 | 试管、量筒、导管、酒精灯 | 冰醋酸、无水乙醇、饱和Na2CO3溶液 |
| | | | |
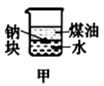
| A.长时间看到Fe(OH)2白色沉淀 | B.证明ρ(煤油)<ρ(钠)<ρ(水) | C.探究氧化性:KMnO4>Cl2>I2 | D.比较NaHCO3、Na2CO3 , 的热稳定性 |
|
选项 |
现象或事实 |
解释 |
|
A |
Na2O2常用于潜水艇或呼吸面具的供氧剂 |
Na2O2与H2O、CO2反应产生O2 |
|
B |
常用铁盐做净水剂 |
Fe3+生成吸附能力强的Fe(OH)3胶体 |
|
C |
FeCl3溶液可用于刻制印刷铜电路板 |
发生反应2Fe3++Cu=2Fe2++Cu2+ |
|
D |
在医疗上烧碱可用于治疗胃酸过多 |
烧碱可与胃酸反应 |
其操作步骤如下:
a.取20%白磷的乙醚溶液0.5mL,加蒸馏水60mL。
b.先滴加1%氯化金水溶液0.75mL,再滴加一定浓度的K2CO3溶液0.6mL,振荡变成棕红色。
c.加热煮沸至溶液变成透明红色。
d.分离提纯,除去无机溶质。
所得分散系中,金颗粒直径在5—10nm之间。
请回答下列问题:
-
(1) 从分散系粒子大小角度,该分散系属于,其分散质是。
-
(2) “分离提纯”步骤中,分离方法在化学中叫(填“蒸发”、“过滤”、“蒸馏”、“渗析”、“萃取”、“分液”、“升华”),证明
 进入无机溶质的操作方法为:。
进入无机溶质的操作方法为:。
-
(3) 某课外活动小组进行Fe(OH)3胶体的制备实验并检验其性质。
a.若将饱和FeCl3溶液分别滴入下列物质中,能形成胶体的是。
A.冷水 B.沸水 C. NaOH溶液 D. NaCl溶液
b.制备Fe(OH)3胶体对应的离子方程式为:
c.向FeCl3溶液分别滴入NaOH溶液对应的离子方程式为:
向Fe(OH)3胶体中逐滴加稀盐酸,结果出现了一系列变化。先出现红褐色沉淀,原因是。随后沉淀溶解,此反应的离子方程式是。
-
(1) 以上物质中属于电解质的是,属于非电解质的是(填序号,下同)
-
(2) 以上物质中能导电的是.
-
(3) ⑧在水中的电离方程式为.
-
(4) 实验室制备⑤的操作为.
-
(5) ①的溶液和⑨混合后的离子方程式为.