物质检验实验方案的设计 知识点题库
①溶于水,得无色溶液;
②在所得溶液中滴入AgNO3溶液,生成白色沉淀(说明:Ag2CO3为白色沉淀);
③再滴加稀硝酸,沉淀量减少但不完全消失,同时有气泡生成.
根据上述现象判断:
(1)白色固体一定含有的成分是 ,可能含有的成分是 .
(2)请写出上述实验③中有关反应的离子方程式

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)═Na2SO3(aq)+H2S(aq) (Ⅰ)
2H2S(aq)+SO2(g)═3S(s)+2H2O(l) (Ⅱ)
S(s)+Na2SO3(aq)  Na2S2O3(aq) (Ⅲ)
Na2S2O3(aq) (Ⅲ)
-
(1) 仪器组装完成后,关闭两端活塞,向装置B中的长颈漏斗内注入液体至形成一段液注,若,则整个装置气密性良好.装置D的作用是.装置E中为溶液.
-
(2) 为提高产品纯度,应使烧瓶C中Na2S和Na2SO3恰好完全反应,则烧瓶C中Na2S和Na2SO3物质的量之比为.
-
(3) 装置B的作用之一是观察SO2的生成速率,其中的液体最好选择.
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液d.饱和NaHCO3溶液
实验中,为使SO2缓慢进入烧瓶C,采用的操作是.已知反应(Ⅲ)相对较慢,则烧瓶C中反应达到终点的现象是.反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器有.
a.烧杯 b.蒸发皿 c.试管 d.锥形瓶
-
(4) 反应终止后,烧瓶C中的溶液经蒸发浓缩即可析出Na2S2O3•5H2O,其中可能含有Na2SO3、Na2SO4等杂质.利用常见试剂设计实验,检测产品中是否存在Na2SO4 , 简要说明实验操作,现象和结论:.
已知Na2S2O3•5H2O遇酸易分解:S2O32﹣+2H+═S↓+SO2↑+H2O.
实验序号 | 实验步骤 |
① | 将镁条用砂纸打磨后,放入沸水中;再向溶液中滴加酚酞溶液 |
② | 向新制得的Na 2S溶液中滴加新制的氯水 |
③ | 将一小块金属钠放入滴有酚酞溶液的冷水中 |
④ | 将镁条投入稀盐酸中 |
⑤ | 将铝条投入稀盐酸中 |
⑥ | 向AlCl 3溶液中滴加NaOH溶液至过量 |
请整理并完成实验报告.
-
(1) 实验目的:
-
(2) 实验用品:试剂:金属钠,镁条,铝条,稀盐酸,新制氯水,新制Na 2S溶液,AlCl 3溶液,NaOH溶液等.
仪器:①,②,③,试管夹,镊子,小刀,玻璃片,砂纸等.
-
(3) 实验内容:(完成下列表格中的实验现象和化学方程式)
实验序号
实验步骤(略)
实验现象
化学方程式
①
②
③
④
⑤
⑥
-
(4) 实验结论:.
-
(5) 请用原子结构的知识简单解释上述结论.

| 选项 | 实验 | 现象 |
| A | 将水蒸气通过灼热的铁粉 | 黑色粉末变为红褐色 |
| B | 在酒精灯上加热用砂纸打磨过的铝箔 | 铝箔变软,失去光泽,熔化的铝并不滴落 |
| C | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| D | 加热放在坩埚中的小块钠 | 钠先熔化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向溶液X中先滴加稀硝酸,再滴加Ba(NO3)2溶液 | 出现白色沉淀 | 溶液X不一定含有SO42- |
| B | 溴乙烷与NaOH溶液共热后,加HNO3酸化的AgNO3溶液 | 出现淡黄色沉淀 | 溴乙烷发生了水解 |
| C | 向淀粉KI溶液中不断通入Cl2 | 溶液先变蓝后褪色 | Cl2先将I-氧化为I2 , 后可能又将I2氧化。 |
| D | 混合气体通入高锰酸钾溶液中 | 溶液紫红色褪去 | 混合溶液中一定没有甲烷 |


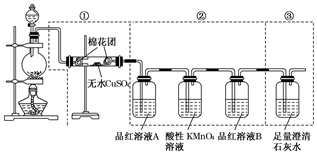
-
(1) ①中无水硫酸铜的作用是。
-
(2) ②中酸性KMnO4溶液的作用是。
-
(3) ②中两次用到品红溶液,它们的作用分别是A,B。
-
(4) ③中出现的现象是,
发生反应的离子方程式是。


请回答:
-
(1) 仪器X的名称是:,向其中加入右图所示的浓盐酸,其物质的量浓度是mol/L。
-
(2) 装置E的作用是:。
-
(3) 请写出发生装置A中的化学方程式,并用双线桥法表示电子转移的方向和数目。
-
(4) 装置C中潮湿的Cl2与Na2CO3以等物质的量反应,生成NaHCO3、气体Cl2O和另一种盐,试写出该反应化学方程式:。
-
(5) 某学习小组用下图装置研究气体X的性质,气体X的主要成分是氯气,其中含有少量水蒸气。请回答下列问题:

分别描述B、C装置中的现象:B,C,从物质性质说明B、C装置中现象不同的原因:。
 、Ca2+、Cu2+、
、Ca2+、Cu2+、 、
、 、Cl-、Br-、
、Cl-、Br-、 中的若干种,离子的物质的量浓度都为0.1 mol/L。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如图所示实验,则下列关于原溶液的判断正确的是( )
中的若干种,离子的物质的量浓度都为0.1 mol/L。往该溶液中加入过量的BaCl2和盐酸的混合溶液,无白色沉淀生成。某同学另取少量原溶液,设计并完成如图所示实验,则下列关于原溶液的判断正确的是( )
 、Br- , 是否存在Na+、K+需要通过焰色反应来确定
C . 肯定不存在的离子是Ca2+、Cu2+、
、Br- , 是否存在Na+、K+需要通过焰色反应来确定
C . 肯定不存在的离子是Ca2+、Cu2+、 、
、 , 是否含
, 是否含 另需实验验证
D . 若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响
另需实验验证
D . 若步骤中Ba(NO3)2和HNO3的混合溶液改用BaCl2和盐酸的混合溶液,则对溶液中离子的判断无影响

已知:①图中所列各步变化均已完全反应;②气体乙中含有2种单质气体。
-
(1) 化合物甲的化学式是,气体丁的电子式为。
-
(2) 步骤①的化学方程式为,步骤②的离子方程式为。
-
(3) 化合物甲的某种晶体在一定条件下能溶于NaOH溶液,并有刺激性气味的气体逸出。
①化合物甲与NaOH溶液反应的化学方程式为。
②若检验所得溶液显碱性,常用到的试剂是;若反应所得溶液中还存在另一种阴离子,则检验该阴离子常用的试剂是。
I.碳化铝(Al4C3)与水反应可制得CH4。
II.银氨溶液{含[Ag(NH3)2]+、OH-与CO反应产生银镜(Ag)。
III.CH4被CuO氧化的氧化产物为CO和CO2。
某学习小组对III表示质疑并在老师的指导下进行实验探究。回答下列问题:

-
(1) 写出甲装置中反应的化学方程式。
-
(2) 该实验装置的接口连接顺序为(填字母),连接好装置后,进行的第一步实验操作为。
-
(3) 乙装置的作用是,丙中实验现象是。
-
(4) 若丁、戊两装置中出现了特征实验现象,则说明反应产生了(填化学式)。综合以上实验现象,CH4和CuO的反应还有一种产物没有检验,若要检验该产物,应。
选项 | 实验目的 | 实验操作 |
A | 制备无水AlCl3 | 蒸发Al和稀盐酸反应后的溶液 |
B | 验证结合H+的能力:CO | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 |
C | 验证可溶性MR为强酸强碱盐 | 25℃,测得MR溶液的pH=7 |
D | 探究浓度对反应速率的影响 | 向2支各盛有5mL不同浓度的NaHSO3溶液的试管中同时加入2mL5%H2O2溶液,观察实验现象 |
 溶液中通入足量
溶液中通入足量 , 生成淡黄色沉淀,证明
, 生成淡黄色沉淀,证明 具有氧化性
B . 向淀粉水解溶液中滴加少量新制
具有氧化性
B . 向淀粉水解溶液中滴加少量新制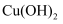 悬浊液,加热无砖红色沉淀,证明淀粉未水解
C . 向丙烯醇中滴加酸性
悬浊液,加热无砖红色沉淀,证明淀粉未水解
C . 向丙烯醇中滴加酸性 溶液,溶液褪色,证明丙烯醇中含有碳碳双键
D . 某溶液中加入盐酸,生成使澄清石灰水变浑浊的气体,则溶液中一定含有
溶液,溶液褪色,证明丙烯醇中含有碳碳双键
D . 某溶液中加入盐酸,生成使澄清石灰水变浑浊的气体,则溶液中一定含有 或
或
-
(1) I.某同学将铁铝合金样品溶解后取样25.00mL,分离并测定Fe3+的浓度,实验方案设计如下:

已知:乙醚[(C2H5)2O]是一种易挥发、易燃、有麻醉性的有机化合物,沸点为34.5℃,微溶于水。在较高的盐酸浓度下,Fe3+与HCl、乙醚形成化合物[(C2H5)2OH][FeCl4]而溶于乙醚;当盐酸浓度降低时,该化合物解离。
完成下列填空:
操作A的名称是。经操作A后,请设计实验方案判断Fe3+是否有残留。
-
(2) 滴定前,加入适量溶液B进行酸化,则B可能是。
a.H2SO3-H3PO4 b.H2SO4-H3PO4
c.HNO3-H3PO4 d.HI-H3PO4
-
(3) 滴定达到终点时,消耗0.1000 mol·L-1 K2Cr2O7溶液6.00 mL(生成物中Cr元素为+3价)。根据该实验数据,试样X中c(Fe3+)为。
-
(4) 上述测定结果存在一定的误差,为提高该滴定结果的精密度和准确度,可采取的措施是____。A . 稀释被测试样 B . 减少被测试样取量 C . 增加平行测定次数 D . 降低滴定剂浓度
-
(5) II.利用下图装置和试剂可以测定铁铝合金样品中的铝含量。

请回答:
下列有关该实验的说法中正确的是____。
A . 由于恒压分液漏斗的存在,该装置不能进行气密性检查 B . 读数前需将量气管C上下移动使B、C中的液面相平 C . 反应完成后生成的氢气都要转移至装置B中 D . 需要控制NaOH的量以防止产生气体过多超过量气装置的量程 -
(6) 若将恒压分液漏斗(A)去掉导管a,改成普通分液漏斗,则测得铁铝合金中的铝含量,(填“偏大”、“偏小”或“不变”),请说明理由。
选项 | 实验目的 | 实验方案 | 实验结论 |
A | 配制 | 称取 | 所得 |
B | 探究Fe与水蒸气高温反应所得固体中铁元素的化合价 | 取固体于试管中,加足量稀硫酸,有无色气体产生,将溶液分成两份,一份滴加 | 固体中铁元素化合价为 |
C | 检验 | 取少量固体溶解,加入足量 |
|
D | 探究Cu与稀硫酸反应中 | 取适量铜粉于试管,加入稀硫酸,加热,无明显现象;再加入少量 |
|
 <AlO
<AlO
 溶液
溶液 固体溶解后,用
固体溶解后,用 容量瓶配制溶液。
容量瓶配制溶液。
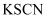 溶液,溶液变血红色;另一份滴加少量
溶液,溶液变血红色;另一份滴加少量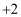 价、
价、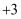 价
价 固体是否被氧化
固体是否被氧化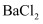 溶液,产生白色沉淀;再加入足量稀盐酸,沉淀部分溶解。
溶液,产生白色沉淀;再加入足量稀盐酸,沉淀部分溶解。 的作用
的作用


