海水资源及其综合利用 知识点题库
-
(1) Ⅰ、下列有关海水综合利用的说法正确的是( )A . 电解饱和食盐水可制得金属钠 B . 海带提碘只涉及物理变化 C . 海水提溴涉及到氧化还原反应 D . 海水提镁涉及到复分解反应
-
(2)
Ⅱ、铁在自然界分布广泛,在工业、农业和国防科技中有重要应用。

回答下列问题:
(1)用铁矿石(赤铁矿)冶炼生铁的高炉如图(a)所示。原料中除铁矿石和焦炭外含有 。除去铁矿石中脉石(主要成分为SiO2)的化学反应方程式为 ;高炉排出气体的主要成分有N2、CO2和 (填化学式)。
(2)已知:①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) △H=+494kJ/mol
②CO(g)+1/2O2(g)=CO2(g) △H=-283kJ/mol
③C(s)+1/2O2(g)=CO(g) △H=-110kJ/mol
则反应 Fe2O3(s)+3C(s)+3/2O2(g)=2Fe(s)+3CO2(g)的ΔH= kJ·mol-1。理论上反应 放出的热量足以供给反应 所需的热量(填上述方程式序号)
(3)有人设计出“二步熔融还原法”炼铁工艺,其流程如图(b)所示,其中,还原竖炉相当于高炉的 部分,主要反应的化学方程式为 ;熔融造气炉相当于高炉的 部分。
(4)铁矿石中常含有硫,使高炉气中混有 SO2污染空气,脱SO2的方法是 。
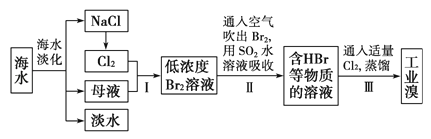
海水是巨大的资源宝库,从海水中提取食盐和溴的过程如下:已知:
①海水中溴元素(以Br﹣表示)的浓度0.068g/L;
②Br2的沸点为59℃,微溶于水,有毒性和强腐蚀性.
-
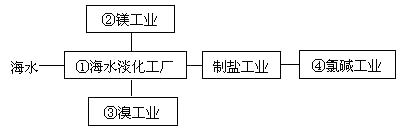
(1) 请写出一种海水淡化的方法:
-
(2) 海水中溴离子的物质的量浓度为
-
(3) 步骤Ⅰ中已获得低溶度的含Br2溶液,步骤Ⅱ中又将Br2还原为Br﹣ , 步骤Ⅲ又得到Br2 , 其目的为
-
(4) 步骤Ⅱ用SO2水溶液吸收Br2 , 吸收率可达95%,有关反应的离子方程式为
-
(5) 工业溴提纯可用蒸馏法,蒸馏时加热方法最好采用 ,蒸馏装置中仪器连接均不能用橡胶塞和橡胶管,其原因是
 Br2
B . 海产品(如海带等)
Br2
B . 海产品(如海带等) 
 滤液
滤液 
 I2
C . 海水
I2
C . 海水  Mg(OH)2
Mg(OH)2  MgO
MgO  Mg
D . 铝土矿
Mg
D . 铝土矿  滤液
滤液  Al(OH)3
Al(OH)3 
 Al
Al


-
(1) 指出图中的明显的错误:(任填一处);
-
(2) 实验时A中除加入海水外,还需加入,其作用是.
A.把盛有溶液的分液漏斗放在铁架台的铁圈中;
B.把50mL碘水和15mL CCl4加入分液漏斗中,并盖好玻璃塞;
C.检验分液漏斗活塞和上口的玻璃塞是否漏液;
D.倒转漏斗振荡,并不时旋开活塞放气,最后关闭活塞,把分液漏斗放正;
E.旋开活塞,用烧杯接收下层溶液;
F.从分液漏斗上口倒出上层溶液;
G.将分液漏斗上口的玻璃塞打开或使塞上的凹槽或小孔对准分液漏斗口上的小孔;
H.静置、分层.
就此实验完成下列填空:
-
(1) 正确操作步骤的顺序是(用上述各操作的编号字母填写):→→→A→H→→E→F
-
(2) D步骤为什么要不时旋开活塞放气?.
-
(3) 上述E步骤的操作中应注意.
-
(4) 上述G步骤操作的目的是.
-
(5) 能选用CCl4从碘水中萃取碘的原因是.

-
(1) 贝壳的主要化学成分为(写化学式).
-
(2) 写出反应②的离子方程式:.
-
(3) 根据流程图可知,可循环利用的物质是.
-
(4) Mg与CO2反应时,有白色粉末并有黑色固体生成.请写出Mg与CO2反应的化学方程式,并用单线桥标出电子转移的方向与数目..
-
(5) Na比Mg和Al要活泼.将Na投入到Fe2(SO4)3溶液中会发生剧烈的化学反应,其离子方程式为.
-
(1) 写出“海洋元素”的元素符号,该单质的苯溶液颜色为
-
(2) 写出NaHCO3溶于水的电离方程式:
-
(3) 用离子方程式表示用NaOH溶液处理尾气Cl2:
-
(4) 有以下八种物质:①盐酸 ②酒精 ③液氯 ④硫酸铵晶体 ⑤水银 ⑥硫酸 ⑦澄清石灰水 ⑧二氧化硫,其中属于酸性氧化物的是(填序号,下同),属于盐的是,能导电的是,属于电解质的是

已知:MgCl2 · 6H2O 受热生成 Mg(OH)Cl 和 HCl 气体等。下列有关说法正确的是( )
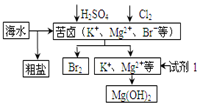
①试剂1可以选用NaOH溶液;
②从苦卤中提取Br2的反应的离子方程式为:2Br-+Cl2=Br2+2Cl-
③工业上,电解熔融MgO冶炼金属镁可减小能耗;
④制铝:工业上电解熔融氯化铝来制备铝;
⑤制钠:电解饱和NaCl溶液;
⑥炼铁:CO在高温下还原铁矿石中的铁

请填写下列空白:
-
(1) 步骤①灼烧海带时,除需要三脚架外,还需要用到的实验仪器是(从下列仪器中选出所需的仪器,用标号字母填写在空白处)___________.A . 烧杯 B . 坩埚 C . 表面皿 D . 泥三角 E . 酒精灯 F . 干燥器
-
(2) 步骤③的实验操作名称是;步骤⑥的目的是从含碘苯溶液中分离出单质碘和回收苯,该步骤的实验操作名称是.
-
(3) 步骤⑤是萃取、分液,某学生选择用苯来提取碘的理由是.
-
(4) 请设计一种检验提取碘后的水溶液中是否还含有单质碘的简单方法是:.
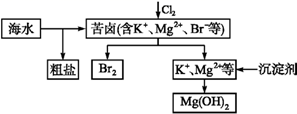
-
(1) 在工业生产中金属冶炼的原理错误的是
A 电解熔融的 NaCl 来制取 Na
B 电解熔融的 AlCl3 来制取 Al
C CO 还原 Fe2O3 制取 Fe
D 铝热反应原理制锰:4Al+3MnO2
 3Mn+2 Al2O3
3Mn+2 Al2O3 -
(2) 下图是从海水中提取溴的简单流程:

提取溴的过程中,经过 2 次 Br-
 Br2 转化的目的是
Br2 转化的目的是 -
(3) 吸收塔中发生反应的离子方程式是
-
(4) 海带中富含碘元素,实验室从海带中提取 I2 的途径如下图所示:

①步骤 I 灼烧海带至灰烬时所用的主要仪器名称是 。
②步骤 IV 向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式 。
③步骤 V 加入萃取剂 M 为 ,步骤 VI 从 I2 的有机溶液获得 I2 可以用 的方法。
-
(1) I.工业上对海水资源综合开发利用的部分工艺流程如下图所示:

请回答下列问题:
物质C和M均为强氧化性物质,则C的电子式为,M的学化式为。
-
(2) 反应⑤的化学方程式是。
-
(3) 工业制镁采用电解熔融氯化镁,不采用电解熔融氧化镁的原因是。
-
(4) 将氯化镁晶体(MgCl2·6H2O)加热到523℃以上,该晶体可以分解得到耐火材料氧化镁和两种气态化合物,其中一种气体常温下为无色液体,请写出MgCl2·6H2O在523℃时发生以上分解的化学方程式是。
-
(5) II.其课外小组在实验室完成了下列有关实验,设计以下装置(夹持装置己略去),进行实验,模拟海水提溴的部分过程。
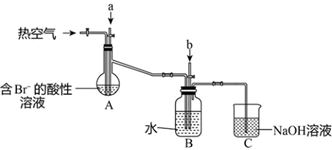
a是一种黄绿色气体。A装置中通入a气体的目的是(用离子方程式表示)。
-
(6) 反应过程中,B装置中有
 生成,则气体b的化学式是。检验B装置的溶液中含有
生成,则气体b的化学式是。检验B装置的溶液中含有  的方法是。
的方法是。
-
(7) C装置的作用是。
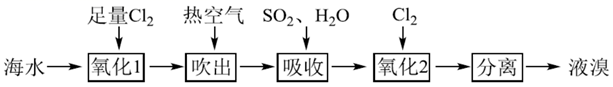
下列有关说法错误的是( )
 溶液制得
B . 吹出后剩余溶液中可能大量存在的离子有
溶液制得
B . 吹出后剩余溶液中可能大量存在的离子有  、
、  、
、  、
、  C . 吸收过程发生反应的离子方程式为
C . 吸收过程发生反应的离子方程式为 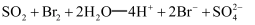 D . 氧化2所得溶液可通过萃取分离出溴
D . 氧化2所得溶液可通过萃取分离出溴
![]()
下列说法正确的是( )



