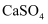金属的电化学腐蚀与防护 知识点
金属的电化学腐蚀:是指金属在有电解质溶液中发生原电池而损耗的过程,常见的腐蚀有析氢腐蚀和吸氧腐蚀。
金属的电化学防护:是指通过原电池进行金属的保护,将保护的金属做原电池的正极进行保护。
金属的电化学防护:是指通过原电池进行金属的保护,将保护的金属做原电池的正极进行保护。
金属的电化学腐蚀与防护 知识点题库
利用右图装置探究铁在海水中的电化学防护,下列说法不正确的是( )
A . 若X为锌棒,开关K置于M处,可减缓铁的腐蚀
B . 若X为锌棒,开关K置于M处,铁电极的反应:Fe﹣2e﹣→Fe2+
C . 若X为碳棒,开关K置于N处,可减缓铁的腐蚀
D . 若X为碳棒,开关K置于N处,铁电极的反应:2H++2e﹣→H2↑
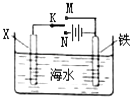
图Ⅰ的目的是精炼铜,图Ⅱ的目的是保护钢闸门.下列说法不正确的是( )
A . 图Ⅰ中a为纯铜
B . 图Ⅰ中SO42﹣向b极移动
C . 图Ⅱ中如果a、b间连接电源,则a连接负极
D . 图Ⅱ中如果a、b间用导线连接,则X可以是铜
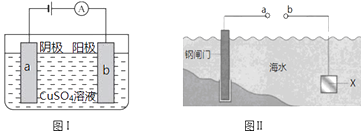
如图,各烧杯中盛有海水,铁在其中被腐蚀时由快到慢的顺序是( )
A . ④>②>①>③>⑤>⑥
B . ⑥>④>②>①>③>⑤
C . ④>②>⑤>③>⑥>①
D . ⑥>③>②>④>①>⑤
下列有关物质的性质和该性质的应用均正确的是( )
A . 常温下浓硫酸能使铝发生钝化,可在常温下用铝制贮罐贮运浓硫酸
B . 二氧化硅不与任何酸反应,可用石英制造耐酸容器
C . 二氧化氯具有还原性,可用于自来水的杀菌消毒
D . 铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
一定条件下,碳钢腐蚀与溶液pH的关系如下:
pH | 2 | 4 | 6 | 6.5 | 8 | 13.5 | 14 |
腐蚀快慢 | 较快 | 慢 | 较快 | ||||
主要产物 | Fe2+ | Fe3O4 | Fe2O3 | FeO2﹣ | |||
下列说法不正确的是( )
A . 在pH<4溶液中,碳钢主要发生析氢腐蚀
B . 在pH>6溶液中,碳钢主要发生吸氧腐蚀
C . 在pH>14溶液中,碳钢腐蚀的正极反应为O2+4H++4e﹣═2H2O
D . 在煮沸除氧气后的碱性溶液中,碳钢腐蚀速率会减缓
化学是材料科学发展的基础.请回答:
-
(1) 合金在生活中的应用很普遍,其优点是,常见的合金有.
-
(2) 金属的腐蚀使我们生活中常看到的现象.家用铁锅洗后容易生锈,请举出一种避免生锈的办法.
-
(3) 服用药物时要对症下药.以碳酸氢钠为主要成分的药物适合治疗.
-
(4) 蛋白质是生命的基础,没有蛋白质就没有生命.蛋白质的基石是.常利用(填“盐析”“变性”或“颜色反应”)分离、提纯蛋白质.
下列叙述不正确的是( )
A . 在镀件上电镀铜时,可用金属铜作阳极
B . 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀
C . 工业上电解饱和食盐水制烧碱,NaOH在阴极产生
D . 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应
研究电化学腐蚀及防护的装置如图所示.下列有关说法正确的是( )

A . 锌片发生氧化反应作阴极
B . 电子从铁片经过导线流向锌片
C . 铁片上电极反应为:O2+2H2O+4e→4OH﹣
D . 该装置可用于研究外加电流阴极保护法
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | Si有良好的半导体性能 | Si可用于制备光导纤维 |
B | 铁比铜活泼 | 铜板上的铁钉在潮湿空气中容易生锈 |
C | 蛋白质和淀粉都是高分子化合物 | 蛋白质和淀粉水解最终产物均是葡萄糖 |
D | 汽油和植物油都属于烃 | 汽油和植物油都可以燃烧 |
A . A
B . B
C . C
D . D
下列有关金属腐蚀与防护的说法正确的是( )
A . 钢铁锈蚀时,铁原子失去电子成为Fe3+ , 而后生成Fe(OH)3 , 再部分脱水成为氧化铁的水合物
B . 当镀锡铁制品的镀层破损时,镀层仍能对铁制品起保护作用
C . 在海轮外壳连接锌块保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
D . 可将地下输油钢管与外加直流电源的正极相连以保护它不受腐蚀
-
(1) 电化腐蚀是钢铁发生腐蚀的主要原因,当水膜氢离子浓度较小时,主要发生腐蚀,其负极反应式为,正极反应式为。
-
(2) 将氯化铁溶液蒸干灼烧得到的固体物质是;(填化学式,下同)将硫酸铝溶液蒸干得到的固体物质是 。
-
(3) 除CaSO4水垢的方法,写出反应的化学方程式、;热的纯碱溶液洗涤效果更好的原理是;明矾净水的离子方程式。
-
(4) 在2 mL 0.1 mol·L-1的NaCl溶液中,加入2 mL 0.1 mol·L-1的AgNO3溶液,可观察到,此反应的离子方程式为。 将此混合液过滤,滤渣加入2 mL 0.1 mol·L-1的KI溶液,搅拌,可观察到,反应的离子方程式为。
-
(5) 对于Ag2S(s)
 2Ag+(aq)+S2-(aq),其Ksp的表达式为。
2Ag+(aq)+S2-(aq),其Ksp的表达式为。
钢铁的电化学腐蚀原理如图所示,下列有关说法中错误的是( )
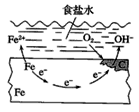
A . 铁片里的铁和碳与食盐水形成无数的微小原电池
B . 铁电极发生氧化反应
C . 负极的电极反应方程式为O2+4e-+2H2O=4OH-
D . 放置一段时间后,铁片上有铁锈出现
潮湿环境、Cl-、溶解氧是造成青铜器锈蚀的主要环境因素,腐蚀严重的青铜器表面大多存在起催化作用的多孔催化层。图为青铜器发生电化学腐蚀的原理示意图,下列说法正确的是( )
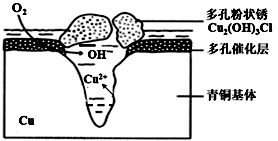
A . 腐蚀过程中,青铜基体是正极
B . 若有64gCu腐蚀,理论上耗氧体积为22.4L(标准状况)
C . 多孔催化层的形成加速了青铜器的腐蚀速率,是因为改变了反应的焓变
D . 环境中的Cl-、正负极产物作用生成多孔粉状锈,其离子方程式为:2Cu2++3OH-+Cl-=Cu2(OH)3Cl↓
某化学小组进行电化学研究,甲同学设计如图所示装置,乙同学利用甲同学的装置和桌面上其他的药品与材料,不能完成的实验是( )
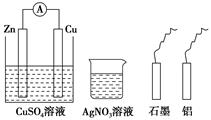
A . 使甲同学装置中的正极变为负极
B . 设计一个新的原电池
C . 在石墨电极上镀锌
D . 使锌电极受到保护
下列关于如图所示的实验装置的判断中错误的是( )
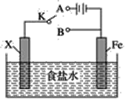
A . 若X为碳棒,开关K置于A处可减缓铁的腐蚀
B . 若X为锌棒,开关K置于A或B处均可减缓铁的腐蚀
C . 若X为锌棒,开关K置于B处时,为牺牲阳极的阴极保护法
D . 若X为碳棒,开关K置于B处时,铁电极上发生的反应为2H++2e-=H2↑
铅霜(醋酸铅),又称为“铅糖”,其古代制法为“以铅杂水银十五分之一,合炼作片,置醋瓮中,密封,经久成霜。”下列相关说法正确的是( )
A . “铅糖”有甜味,可充当食品甜味剂
B . “瓮”为铁质容器
C . “经久成霜”是结晶的过程
D . 该制法以铅作正极,汞作负极,发生电化学腐蚀
将金属M连接在钢铁设施表面构成原电池,可减缓水体中钢铁设施的腐蚀。在如图所示的情境中,下列有关说法正确的是( )

A . 钢铁设施上的电极反应式为 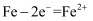 B . 电子流向:金属M→水体→钢铁设施表面
C . M的金属性比Fe的金属性强
D . 钢铁设施在河水中的腐蚀速率比在海水中的快
B . 电子流向:金属M→水体→钢铁设施表面
C . M的金属性比Fe的金属性强
D . 钢铁设施在河水中的腐蚀速率比在海水中的快
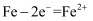 B . 电子流向:金属M→水体→钢铁设施表面
C . M的金属性比Fe的金属性强
D . 钢铁设施在河水中的腐蚀速率比在海水中的快
B . 电子流向:金属M→水体→钢铁设施表面
C . M的金属性比Fe的金属性强
D . 钢铁设施在河水中的腐蚀速率比在海水中的快
“劳动最光荣、劳动最崇高、劳动最伟大、劳动最美丽”。下列劳动与所涉及的化学知识不相符的是( )
选项 | 劳动项目 | 化学知识 |
A | 为保护地下钢管不被腐蚀,将钢管与直流电源负极相连 | 采用了牺牲阳极法进行防护 |
B | 使用纯碱溶液去油污 |
|
C | 石灰石可减少煤燃烧的 | 高温下石灰石和空气可将 |
D | 常用石墨作化学电池、电解池的电极 | 石墨的化学性质稳定且导电性好 |
A . A
B . B
C . C
D . D
表面皿都中装有混合了饱和食盐水、酚酞和铁氰化钾溶液的琼脂,分别将缠有铜丝的铁钉(图A)和缠有锌片的铁钉(图B)放置其中,如图所示,一段时间后b处和c处出现变红现象

已知: 和铁氰化钾溶液会生成蓝色沉淀。下列说法错误的是( )
和铁氰化钾溶液会生成蓝色沉淀。下列说法错误的是( )
A . 发生氧化反应的是a处和d处
B . 图A中a处出现蓝色沉淀
C . b处和c处电极反应式为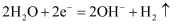 D . 对铁钉腐蚀起防护作用的是图B
D . 对铁钉腐蚀起防护作用的是图B
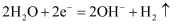 D . 对铁钉腐蚀起防护作用的是图B
D . 对铁钉腐蚀起防护作用的是图B
回答下列问题:
-
(1) X、Y、Z、W均为中学化学中常见物质,一定条件下它们之间有如下转化关系(其它产物已略去)。下列说法错误的是A . 若W是单质铁,则Z溶液可能是
 溶液
B . 若W是氢氧化钠,则X水溶液呈酸性
C . 若W是氧气,则X、Z的相对分子质量可能相差48
D . 若W是强氧化性的单质,则X可能是金属铝
溶液
B . 若W是氢氧化钠,则X水溶液呈酸性
C . 若W是氧气,则X、Z的相对分子质量可能相差48
D . 若W是强氧化性的单质,则X可能是金属铝
-
(2) A是一种常见的铵盐,受热分解可得到碱性气体B,C、D是常见的两种氧化物,E溶液显酸性。A、B、C、D、E是含有一种相同元素的五种化合物,在一定条件下可发生如图所示的转化。

①B的化学式;D的颜色。
②实验室中常用A和另一种固体制备B,写出相应的化学方程式。
-
(3) 电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。
①图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择(填字母标号)。
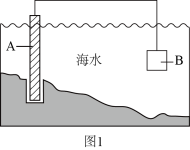
a.碳棒 b.锌板 c.铜板
②镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。E为该燃料电池的(填“正”或“负”)极。F电极上的电极反应式为。
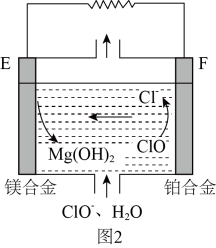
最近更新
 水解使溶液显碱性
水解使溶液显碱性 排放
排放