金属的电化学腐蚀与防护 知识点题库
下列叙述不正确的是( )
A . 金属的电化学腐蚀比化学腐蚀普遍
B . 钢铁在干燥空气里不易腐蚀
C . 用铝质铆钉铆接铁板,铁板易被腐蚀
D . 原电池中电子经外电路由负极流向正极
下列事实与电化学腐蚀无关的是( )
A . 光亮的自行车钢圈不易生锈
B . 黄铜(Cu、Zn合金)制的铜锣不易产生铜绿
C . 铜、铝电线一般不连接起来作导线
D . 生铁比熟铁(几乎是纯铁)容易生锈
炒过菜的铁锅未及时洗净,不久便会因腐蚀而出现红色锈斑.请回答:写出铁锅腐蚀时正极的电极反应式:
下列说法正确的是( )
A . 用镀锡铁做罐头盒,当镀层破坏后锡能对铁提供保护
B . 用铜作电极电解稀硫酸,发生反应:Cu+H2SO4  CuSO4+H2↑
C . 某原电池的电极材料分别为Mg和Al,则Mg一定做负极
D . 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小
CuSO4+H2↑
C . 某原电池的电极材料分别为Mg和Al,则Mg一定做负极
D . 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小
 CuSO4+H2↑
C . 某原电池的电极材料分别为Mg和Al,则Mg一定做负极
D . 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小
CuSO4+H2↑
C . 某原电池的电极材料分别为Mg和Al,则Mg一定做负极
D . 某可逆反应升高温度,活化能大的方向化学反应速率增大程度小
化学能帮助我们更好地认识生活、改善生活.
①家用铁锅未洗净晾干,放置一段时间后出现红褐色锈斑,其主要的原因是铁发生了腐蚀.
②乘车禁止携带物品的部分标识如图所示.在浓硝酸、食盐、汽油、石膏四种物品中,不能携带上车的是.
③过氧乙酸( ![]() )易分解为乙酸和氧气,其稀溶常用于餐具器械的消毒.过氧乙酸分解的化学方程式.某胃药的主要成分是AlbMgc(OH)mCO3 , 常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式.
)易分解为乙酸和氧气,其稀溶常用于餐具器械的消毒.过氧乙酸分解的化学方程式.某胃药的主要成分是AlbMgc(OH)mCO3 , 常用于治疗胃酸过多,写出其中与胃酸反应的化学方程式.

下列叙述错误的是( )
A . 生铁中含有碳,抗腐蚀能力比纯铁弱
B . 用锡焊接的铁质器件,焊接处易生锈
C . 在铁制品上镀铜时,镀件为阳极,铜盐为电镀液
D . 铁管上镶嵌锌块,铁管不易被腐蚀
钢铁在潮湿的空气中往往因电化学过程而被腐蚀,下列方程式在钢铁的电化学腐蚀过程中不存在的是( )
A . Fe﹣2e﹣═Fe2+
B . 2H2O+O2+4e﹣═4OH﹣
C . 2Fe+2H2O+O2═2Fe2++4OH﹣
D . Fe﹣3e﹣═Fe3+
海边铁制品较易被腐蚀的原因是:.写出金属防护的一种常用方法.
我国某大城市今年夏季多次降下酸雨.据环保部门测定,该城市整个夏季酸雨的pH平均为3.2.在这种环境中的铁制品极易被腐蚀.对此条件下铁的腐蚀的叙述不正确的是( )
A . 此腐蚀过程有化学腐蚀也有电化学腐蚀
B . 发生电化学腐蚀时的正极反应为 2H2O+O2+4e﹣═4OH﹣
C . 在化学腐蚀过程中有氢气产生
D . 发生电化学腐蚀时的负极反应为Fe﹣2e﹣═Fe2+
据统计,金属腐蚀造成的损失远远超过火灾、水灾等自然灾害的总和,越来越被世界各国所重视,下面金属的防腐措施中,使用牺牲阳极的阴极保护法的是( )
A . 汽车底盘喷涂油漆
B . 掺防腐的金属制成不锈钢菜刀
C . 钢闸门连接电源负极
D . 地下钢管连接锌块
下列说法中,正确的是( )
A . 钢铁因含杂质而容易发生电化学腐蚀,所以合金都不耐腐蚀
B . 原电池反应是导致金属腐蚀的主要原因,故不能用于减缓金属的腐蚀
C . 钢铁电化学腐蚀的两种类型其主要区别在于水膜的pH不同引起负极反应的不同
D . 无论哪种类型的金属腐蚀,其实质都是金属被氧化
电化学原理被广泛地应用于生产、生活的许多方面。
-
(1) I.制备氯气
工业中用电解饱和食盐水的方法制备氯气,其原理如下图所示。
此过程中能量转化形式为转化为(填“化学能”或“电能”)
-
(2) 电极乙为(填“阴极”或“阳极”),A 口生成的气体是
-
(3) 电解饱和食盐水的离子方程式是
-
(4) 下列有关氯气的说法中正确的是
a.实验室常用排饱和食盐水法收集
b.可使碘化钾溶液变蓝
c.转化为 NaClO、ClO2 等含氯化合物可用于杀菌消毒
-
(5) II.金属防护
某小组同学为探究电极对金属腐蚀与防护的影响,设计如下实验:将饱和食盐水与琼脂(凝固剂,不参与反应)的混合液置于两个培养皿中,向其中滴入少量酚酞溶液和K3Fe(CN)6溶液,混合均匀。分别将包裹锌片和铜片的铁钉放入两个培养皿中,观察现象如下。
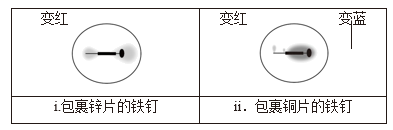
被腐蚀的是包裹的铁钉(填“锌片”或“铜片”)
-
(6) 结合电极反应式解释 i 中现象产生的原因
-
(7) 结合以上实验,请对铁制零件的使用提出建议
为探究海水对钢铁的腐蚀,某兴趣小组设计了如下五种装置,铁片在这五种装置中的腐蚀速率由慢到快的顺序为( )
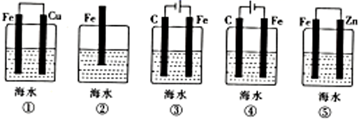
A . ①⑤④③②
B . ③①②④⑤
C . ④③①⑤②
D . ④⑤②①③
选取 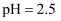 和
和 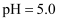 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( )
的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( )
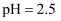 和
和 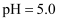 的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( )
的醋酸溶液分别与生铁反应,进行腐蚀实验,测量密闭容器内压强变化情况如图。下列结论错误的是( ) 
A . 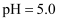 的醋酸溶液中一定存在吸氧腐蚀
B . 酸度不同,腐蚀的主要类型可能不同
C . 两组溶液的pH一定逐渐变大
D . 若改用盐酸进行实验,腐蚀速率一定变大
的醋酸溶液中一定存在吸氧腐蚀
B . 酸度不同,腐蚀的主要类型可能不同
C . 两组溶液的pH一定逐渐变大
D . 若改用盐酸进行实验,腐蚀速率一定变大
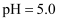 的醋酸溶液中一定存在吸氧腐蚀
B . 酸度不同,腐蚀的主要类型可能不同
C . 两组溶液的pH一定逐渐变大
D . 若改用盐酸进行实验,腐蚀速率一定变大
的醋酸溶液中一定存在吸氧腐蚀
B . 酸度不同,腐蚀的主要类型可能不同
C . 两组溶液的pH一定逐渐变大
D . 若改用盐酸进行实验,腐蚀速率一定变大
下列实验设计能达到相应实验目的的是( )
| | | | |
| A.关闭a,打开b,可检验装置的气密性 | B.比较KMnO4、Cl2、S的氧化性强弱 | C.验证铁钉能发生析氢腐蚀 | D.检验乙醇消去反应的产物乙烯 |
A . A
B . B
C . C
D . D
2019年江西南昌“海昏侯墓”出土了一件青铜白酒蒸馏器。下列说法错误的是( )
A . 在实验室进行蒸馏时,必须使用圆底烧瓶、直形冷凝管、酒精灯、锥形瓶等仪器
B . 我国古代人民常用明水矾除去铜器表面的铜绿(铜锈)
C . 青铜文物和铁质文物在潮湿的土壤环境中容易发生电化学腐蚀
D . 与火法冶铜(以Cu2S为原料)相比,采用湿法冶铜(以CuSO4为原料)的优点是减少了环境污染和能源的消耗
下列有关金属腐蚀的说法正确的是( )
A . 电化学腐蚀是在外加电流作用下不纯金属发生化学反应被损耗的过程
B . 金属的电化学腐蚀和化学腐蚀本质相同,但电化学腐蚀伴有电流产生
C . 钢铁腐蚀最普遍的是吸氧腐蚀,负极吸收氧气,产物最终转化为铁锈
D . 镀锌的铁板比镀锡的铁板更容易被腐蚀
利用NaCl溶液可以进行多种电化学实验或工业生产,请完成下列题目。
-
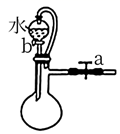
(1) I.某同学在实验室中组装下列实验装置并进行实验探究。
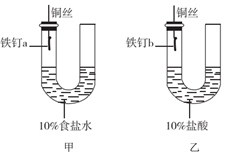
该同学观察到甲装置中的液面变化情况为,长期放置后铁钉a表面逐渐生成铁锈,铁锈主要成分的化学式为。
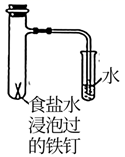
-
(2) 反应过程中观察到乙装置中左边液面降低,右边液面升高,装置中发生原电池反应,正极的电极反应式为。若将乙装置中的铜丝换成铝丝,此时铁钉b被保护而不被腐蚀,此方法被称为。
-
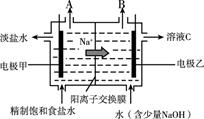
(3) II.工业上使用离子交换膜电解槽电解饱和食盐水生产氯气等重要化工产品。
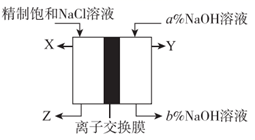
电解槽左侧为(填“阳极室”或“阴极室”)。
-
(4) X和Y是气态物质,其中是H2。
-
(5) 由图可知,a和b的关系为ab(填“>”“ <”或“=”)。
“雪龙2号”从深圳启航,执行中国第36次南极科考任务。下列有关科考船的说法正确的是( )
A . 外壳镶嵌一些铅块可提高科考船的抗腐蚀能力
B . 停靠期间可将电源正极与船体相连保护船体
C . 利用牺牲阳极的阴极保护法保护船体时,正极反应式为 D . 科考船只采用电化学保护法提高船体抗腐蚀能力
D . 科考船只采用电化学保护法提高船体抗腐蚀能力
 D . 科考船只采用电化学保护法提高船体抗腐蚀能力
D . 科考船只采用电化学保护法提高船体抗腐蚀能力
用如图所示装置及试剂进行铁的电化学腐蚀实验探究,测定具支锥形瓶中压强(p)随时间变化关系以及溶解氧(DO)随时间变化关系的曲线如下,下列说法错误的是( )
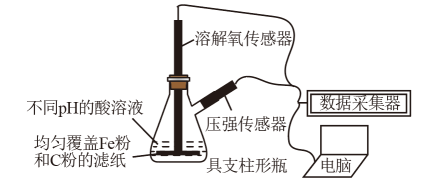
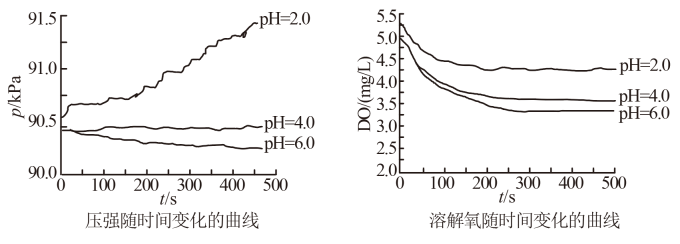
A . 压强增大主要是因为产生了H2
B . 整个过程中,负极电极反应式为Fe-2e-=Fe2+
C . pH=4.0时,不发生析氢腐蚀,只发生吸氧腐蚀
D . pH=2.0时,正极电极反应式为2H++2e-=H2↑和O2+4e-+4H+=2H2O
最近更新