探究卤素单质间的置换反应 知识点题库
(1)提出问题:Fe3+、Br2哪一个的氧化性更强?
(2)猜想
①甲同学认为氧化性:Fe3+>Br2 , 故上述实验现象不是发生化学反应所致,则溶液呈黄色是含 (填化学式,下同)所致.
②乙同学认为氧化性:Br2>Fe3+ , 故上述实验现象是发生化学反应所致,则溶液呈黄色是含 所致.
(3)设计实验并验证
丙同学为验证乙同学的观点,选用下列某些试剂设计出两种方案进行实验,并通过观察实验现象,证明了乙同学的观点确实是正确的.供选用的试剂:
a.酚酞试液 b.CCl4 c.无水酒精 d.KSCN溶液
请你在下列表格中写出丙同学选用的试剂及实验中观察到的现象.(试剂填序号)
选用试剂 | 实验现象 | |
方案1 |
|
|
方案2 |
|
|
(4)应用与拓展
①在足量的稀氯化亚铁溶液中加入l~2滴溴水,溶液呈黄色,所发生的离子反应方程式为 .
②在FeBr2溶液中通入足量 Cl2 , 所发生的离子反应方程式为 .
『资料』 | 溴水是溴单质的水溶液,因溶有溴单质而呈黄色. |
根据已有化学知识及资料,请你参与上述现象形成原因的分析与探究:
(1)提出问题猜想:
猜想Ⅰ:溶液呈黄色是因发生离子反应① ( 填离子方程式)所致.
猜想Ⅱ:溶液呈黄色是因发生离子反应② ( 填离子方程式)所致.
(2)设计实验并验证:
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
所给试剂:酚酞试液、CCl4、无水酒精、KSCN溶液
方案1:取所述黄色溶液于试管中,滴加 并振荡,溶液变红色;则溶液变黄色由反应 所致.
方案2:取所述黄色溶液于试管中,滴加 并振荡;实验现象为 .
(3)实验结论:
以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br﹣ (填“强”或“弱”).
(4)实验反思:
Ⅰ.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是 .
Ⅱ.在100mLFeBr2溶液中通入2.24LCl2(标准状况下),溶液中有1/2的Br﹣被氧化成单质Br2 , 则原FeBr2溶液中FeBr2的物质的量浓度为 mol/L.
-
(1) 加入以上药品的顺序是.
-
(2) 写出①→②的离子方程式,若为氧化还原反应,请标明电子转移的方向和数目:.
-
(3) 写出③→④的化学方程式:.
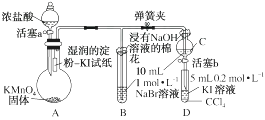
实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.当B中溶液由黄色变为红棕色时,关闭活塞a。
Ⅳ.……
-
(1) 验证氯气的氧化性强于碘的实验现象是。
-
(2) B中溶液发生反应的离子方程式是。
-
(3) 为验证溴的氧化性强于碘,过程Ⅳ的操作和现象是。
-
(4) 过程Ⅲ实验的目的是。
-
(5) 氯、溴、碘单质的氧化性逐渐减弱的原因:同主族元素从上到下,电子层数依次增多,,得电子能力逐渐减弱,非金属性逐渐减弱。
 4NO+6H2O
D . Mg+2HCl=MgCl2+H2↑
4NO+6H2O
D . Mg+2HCl=MgCl2+H2↑
| 相关实验 | 预期目的 | |
| ① | 在两份同浓度同体积的H2O2溶液中,分别加2滴FeCl3溶液和2滴CuCl2溶液,前者放在热水中,后者放在冰水中。观察气泡快慢; | 验证温度对化学反应速率的影响。 |
| ② | 将氯水加入淀粉KI溶液中 | 验证Cl的非金属性比I强 |
| ③ | 在相同温度下,将表面积相同的铝条和镁条投入等体积同浓度的盐酸中,观察产生气泡的速率。 | 比较同周期金属元素的金属性强弱。 |
| ④ | 利用电解质溶液的导电性装置,检测AlCl3溶液的导电性 | 证明AlCl3是离子化合物 |
-
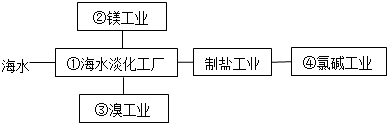
(1) 从海水中获取淡水,历史最久的方法是法
-
(2) 海水中得到粗盐,采用风吹日晒蒸发溶剂的方法,而不是采用降低溶液温度的方法,原因是。
-
(3) 粗盐中含有Ca2+、Mg2+、SO
 等杂质离子,精制时所用试剂为:
等杂质离子,精制时所用试剂为: A.盐酸; B.BaCl2溶液; C.NaOH溶液; D.Na2CO3溶液。
则加入试剂的顺序是(填序号)。
-
(4) 在制镁工业中,电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以作镁蒸气的冷却剂的是___________(填写代号)。A . 水蒸气 B . CO2 C . O2 D . H2
-
(5) 用石灰石、盐酸等提取镁时,发生反应涉及的化学反应类型包含了4种基本反应类型中的3种,其中没有涉及反应类型。
-
(6) 从海水中提取溴常用空气吹出法,即用氯气(Cl2)将海水里溴化钠(NaBr)中的溴置换出来,再用空气吹出溴(Br2).流程示意图如下:


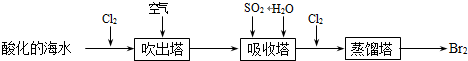
①请写出在吸收塔中发生的反应的离子方程式。
②假设最后在蒸馏塔中获得1mol Br2 , 理论上从酸化的海水开始,至少消耗LCl2(标准状况下)。
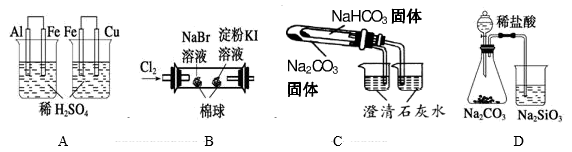
| 实验 | 实验现象 | 结论 |
| A | 左烧杯中铁表面有气泡,右边烧杯中铜表面有气泡 | 氧化性:Al3+>Fe2+>Cu2+ |
| B | 左边棉花变为橙色,右边棉花变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 右烧杯中澄清石灰水变浑浊,左边烧杯中无明显变化 | 热稳定性:Na2CO3>NaHCO3 |
| D | 锥形瓶中有气体产生,烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
|
实验步骤 |
实验现象 |
|
①将氯水滴加到NaBr溶液中,振荡后再加入适量CCl4 , 振荡,静置 |
A、浮在水面上,熔成小球,不定向移动,随之消失 |
|
②将一小块金属钠放入到冷水中 |
B、分层,上层无色,下层紫红色 |
|
③将溴水滴加到NaI溶液中,振荡后再加入适量 CCl4 , 振荡,静置 |
C、浮在水面上,熔成小球,不定向移动,并伴有轻微的爆炸声,很快消失 |
|
④将一小块金属钾放入冷水中 |
D、分层,上层无色,下层棕红色 |
请你帮助该同学整理并完成实验报告。
-
(1) 实验目的:。
-
(2) 实验用品:
①实验试剂:金属钠、金属钾、新制氯水、溴水、0.1mol·L-1溴化钠溶液、0.1 mol·L-1碘化钠溶液、四氯化碳。
②实验仪器:、、、镊子、小刀、玻璃片等。
-
(3) 实验内容(填写与实验方案对应的实验现象的标号和化学方程式):
实验方案
实验现象
化学方程式
①
②
③
④
-
(4) 实验结论:。
| 实验目的 | 方案设计 | 现象和结论 | |
| A | 检验CH3CH2Br在NaOH溶液中是否发生水解 | 将CH3CH2Br与NaOH溶液共热,冷却后,取少量溶液,加入AgNO3溶液 | 若有沉淀产生,则CH3CH2Br发生水解 |
| B | 比较Br2和I2的氧化性强弱 | 将少量溴水加入KI溶液中,再加入CCl4 , 振荡,静置 | 若下层液体呈紫红色,则Br2的氧化性强于I2 |
| C | 检验Fe(NO3)2晶体是否氧化变质 | 将Fe(NO3)2样品溶于稀H2SO4后,滴加KSCN溶液 | 若溶液变红,则Fe(NO3)2晶体已氧化变质 |
| D | 比较HNO2和CH3COOH电离出H+的能力 | 用pH试纸分别测CH3COONa溶液和NaNO2溶液的pH | 若CH3COONa溶液的pH比NaNO2溶液的pH大,则HNO2电离出H+的能力比CH3COOH的强 |
|
族 周期 |
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
2 |
① |
② |
||||||
|
3 |
③ |
④ |
⑤ |
⑥ |
⑦ |
⑧ |
||
|
4 |
⑨ |
⑩ |
请按要求回答下列问题:
-
(1) 写出元素①单质的电子式是,元素②简单氢化物的结构式
-
(2) ③、④、⑨三种元素按原子半径由大到小的顺序排列为(用元素符号表示).
-
(3) 元素⑥、⑦、⑧三种元素最高价氧化物对应水化物的酸性最强的为(用化学式表示).
-
(4) 向元素③的单质与水反应后的溶液中加入元素⑤的单质,发生反应的化学方程式为.
-
(5) 小组利用如图所示装置探究卤族元素的非金属性强弱.
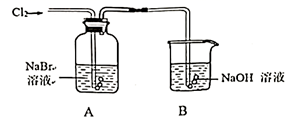
①写出装置A中发生的离子反应方程式.
②取2mL A中橙黄色溶液于试管中,再滴入几滴KI淀粉溶液,观察到溶液变为蓝色.通过以上实验,不能得出非金属性:Br>I,理由.



