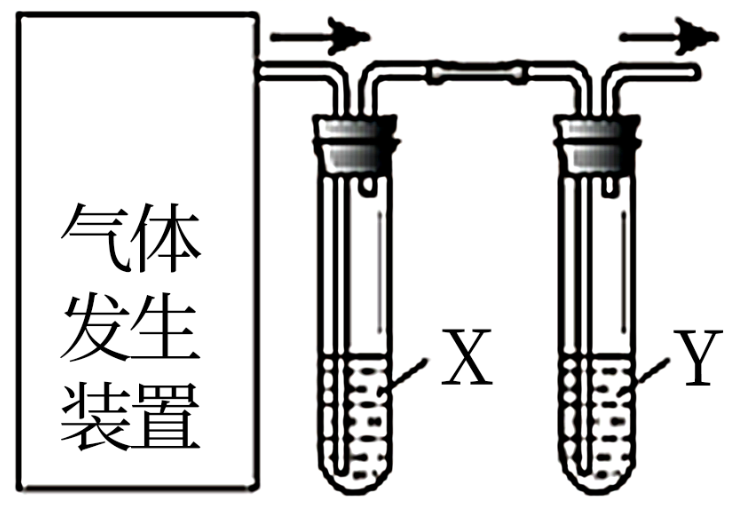
探究卤素单质间的置换反应 知识点题库
Ⅰ.实验目的:探究同一主族元素性质的递变规律.
Ⅱ.实验用品:碘化钠溶液、溴化钾溶液、溴水、氯水、四氯化碳.
仪器:(1) ;(2) .(请填写两件主要的玻璃仪器)
Ⅲ.实验内容:
序号 | 实验方案 | 实验现象 |
① | 将少量氯水滴入盛有适量KBr溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入氯水后,溶液由无色变为橙色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为橙红色 |
② | 将少量溴水滴入盛有适量NaI溶液的试管中,振荡;再滴入少量四氯化碳,振荡 | 滴入溴水后,溶液由无色变为黄色,滴入四氯化碳后,水层颜色变浅,四氯化碳层(下层)变为紫色 |
Ⅳ.实验结论:(3) .
Ⅴ.问题和讨论:
①请用结构理论简单说明得出上述结论的原因:(4)
②由于F2如同Na过于活泼,很难设计一个简单的置换反应实验验证其氧化性强弱.试列举一项事实说明F的非金属性比Cl强:(5) .
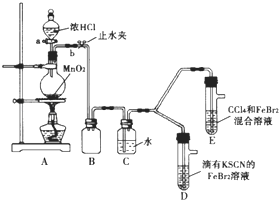
某化学兴趣小组为探究Cl2、Br2、Fe3+的氧化性强弱,设计了如下实验:
(1)①连接仪器:把玻璃导管插入橡胶塞的操作是: ,然后对准橡胶塞上得空稍稍用力转动,将其插入.
②检查气体发生装置A的气密性的操作是:向分液漏斗中注水,若水不能顺利流下,则气密性良好.
(2)整套实验装置存在一处明显不足,请指出 .
用改正后的装置进行实验.实验过程如下:
实验操作 | 实验现象 | 结论 |
打开活塞a,向圆底烧瓶中滴入适量浓盐酸;然后关闭活塞a,点燃酒精灯 | D装置中:溶液变红 E装置中:水层溶液变黄 振荡后CCl4层无明显变化 | Cl2、Br2、Fe3+的氧化性由强到弱的顺序为:
|
(3)因忙于观察和记录,没有及时停止反应,D、E中均发生了新的变化:
D装置中:红色慢慢褪去.
E装置中:CCl4层先由无色变为橙色,后颜色逐渐变成红色.
为探究上述实验现象的本质,小组同学查得资料如下:
Ⅰ.(SCN)2性质与卤素单质类似.氧化性:Cl2>(SCN)2 . Ⅱ.Cl2和Br2反应生成BrCl,它呈红色(略带黄色),沸点为5℃,与水发生水解反应. Ⅲ.AgClO、AgBrO均可溶于水. |
①请用平衡移动原理(结合化学用语)解释Cl2过量时D中溶液红色褪去的原因,请设计简单实验证明上述解释:
②欲探究E中颜色变化的原因,设计实验如下:用分液漏斗分离出E的下层溶液,蒸馏、收集红色物质,取少量,加入AgNO3溶液,结果观察到仅有白色沉淀产生.请结合化学用语解释仅产生白色沉淀的原因 .
实验 | 现象 | 离子方程式 |
1.将少量氯水分别加入盛有NaBr溶液(试管①)和KI溶液(试管②)中,用力振荡后加入少量四氯化碳,振荡,静置 | 写出试管②中的实验现象
| 写出试管①中的离子方程式:
|
2.将少量溴水加入盛有KI溶液(试管③)中,用力振荡后加入少量四氯化碳,振荡,静置 | 现象略 | 写出试管③中的离子方程式:
|
实验结论: 元素非金属性由强到弱的顺序为: . | ||
实验步骤 | 实验现象 | 反应方程式 |
1.将少量氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 离子方程式:
| |
1.将少量溴水加入盛有NaI溶液的试管中,用力振荡后加入少量四氯化碳,振荡、静置 | 化学方程式:
|
结论:(1)卤素单质Cl2 , Br2 , I2的氧化性由强到弱的顺序
(2)同一主族元素从上到下非金属性 .
化学是以实验为基础的学科,化学实验又有定性实验和定量实验之分.利用已学知识对下列实验进行分析并填空:
Ⅰ.
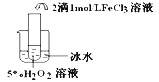
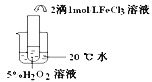
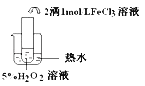
实验目的 | 探究温度对H2O2分解反应速率的影响 | ||
实验 |
|
|
|
实验结论 | 结论: FeCl3在实验中的作用为: | ||
反应方程式 |
|
Ⅱ.
实验目的 | 探究卤素单质氧化性的相对强弱 | |
实验 | 现象 | 离子方程式 |
1.将少量氯水分别加入盛有KBr和NaI溶液的试管中, 振荡后加入CCl4 , 振荡、静置 | (1)溶液分层,上层几 乎无色,下层为橙色. (2) | (1) (2) |
2.将少量溴水加入盛有NaI溶液的试管中,振荡后加入少量CCl4 , 振荡、静置 | / | (3) |
实验结论并从原子结构上解释原因 |
|
Ⅲ.
资料:氯气难溶于饱和氯化钠溶液;实验室可利用MnO2和浓盐酸在加热的条件下制备氯气
实验:某食盐样品中混有NaBr杂质,为测定该食盐样品的纯度,设计实验过程如甲图所示:
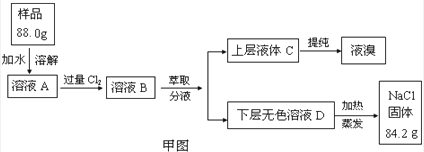
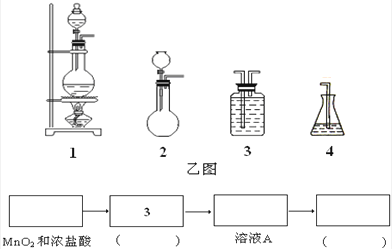
阅读上述资料和实验过程,完成下列填空:
(1)请从乙图中选出四个装置(可重复使用),来完成制取并向溶液A中通入过量Cl2的实验,将所选装置的选项代码填入方框,并在括号中写出装置内所放的化学药品.
(2)为了证明甲图中溶液D中几乎不存在Br﹣ , 可选用的试剂为 (填选项字母).
A.碘水
B.淀粉碘化钾溶液
C.新制氯水和四氯化碳
D.食盐水
(3)依据甲图所示,在萃取操作中应选取的有机溶剂为 .
A.四氯化碳 B.水 C.乙醇 D.苯
(4)在萃取、分液的过程中,把分液漏斗玻璃塞上的凹槽对准漏斗口上的小孔,其目的是
(5)试计算原固体混合物中氯化钠的质量分数为 %.
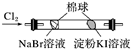
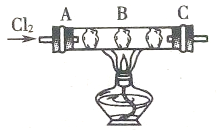
在硬质玻璃管中的A,B,C处依次放有浸有KBr溶液、KI溶液、淀粉溶液的三个棉球(如图所示).向左端导入Cl2 , 在B处加热,可观察到A处棉球呈 色,B处棉球呈 色,C处棉球呈 色.将试管冷却后,在B,C之间的玻璃壁上有 色的 ,这是因为 .
-
(1) 提出问题猜想:
猜想一:溶液呈黄色是因发生离子反应① (填离子方程式)所致.
猜想二:溶液呈黄色是因发生离子反应② (填离子方程式)所致.
-
(2) 设计实验并验证
为验证①与②中是哪个原因导致了溶液变黄色,设计并进行了以下实验.请根据以下所给试剂,进行合理选用,完成实验方案1和方案2:
试剂
酚酞试液、CCl4、无水酒精、KSCN溶液
方案
操作步骤
实验现象
结论
1
取所述黄色溶液于试管中,滴加 并振荡
溶液变红色
反应 所致
2
取所述黄色溶液于试管中,滴加 并振荡
-
(3) 实验结论:以上实验不仅验证了溶液变黄的真实原因,同时证明了Fe2+的还原性比Br﹣ (填“强”或“弱”).
-
(4) 实验反思
I.根据上述实验推测,若在溴化亚铁溶液中滴入足量氯水,再加入CCl4并充分振荡后静止,产生的现象是 .
Ⅱ.在100mLFeBr2溶液中通入2.24L Cl2(标准状况),溶液中有1/2的Br﹣被氧化成单质Br2 , 则原FeBr2溶液中FeBr2的物质的量浓度为
下列说法正确的是( )
-
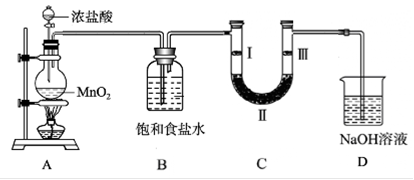
(1) 实验室常用A装置制取氯气,写出实验室制取氯气的化学方程式;
-
(2) 装置B中饱和食盐水的作用是;
-
(3) 装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入;
Ⅰ
Ⅱ
Ⅲ
a
干燥的有色布条
碱石灰
湿润的有色布条
b
干燥的有色布条
无水氯化钙
湿润的有色布条
c
湿润的有色布条
浓硫酸
干燥的有色布条
d
湿润的有色布条
无水氯化钙
干燥的有色布条
-
(4) 装置D的作用是尾气处理,写出烧杯中发生的反应化学方程式;
-
(5) 实验室常用湿润的KI淀粉试纸检验氯气,写出氯气与KI发生反应的化学方程式。
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 少量的Fe粉中加入足量稀HNO3 , 充分反应后,滴入KSCN溶液 | 溶液呈红色 | 稀HNO3将Fe氧化为Fe3+ |
| B | | 左边棉球变为橙色,右边棉球变为蓝色 | 氧化性:Cl2>Br2>I2 |
| C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸先变蓝后变白 | 浓氨水呈碱性且有漂白性 |
| D | 浓HNO3加热 | 有红棕色气体产生 | HNO3有强氧化性 |
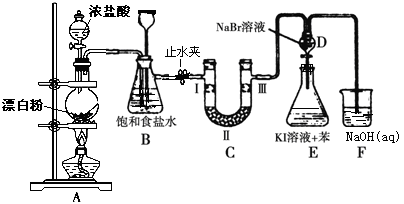
-
(1) 写出A装置生成氯气的化学反应方程式。
-
(2) 装置B除及吸收HCl外还有两个作用, 请写出: ,。
-
(3) 装置C的实验目的是验证氯气是否具有漂白性, 为此C中Ⅰ、Ⅱ、Ⅲ依次放入物质的组合是(填编号)。
编号
1
2
3
4
Ⅰ
干燥的有色布条
湿润的有色布条
干燥的有色布条
湿润的有色布条
Ⅱ
碱石灰
无水氯化钙
硅胶
浓硫酸
Ⅲ
湿润的有色布条
干燥的有色布条
湿润的有色布条
干燥的有色布条
-
(4) 设计装置D、E的目的是比较氯、溴、碘的非金属性。反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是该现象(填“能”或“不能”)说明溴的非金属性强于碘,原因是。
-
(5) 有人提出,装置F中可改用足量的Na2S2O3溶液吸收余氯,试写出相应的离子方程式:。
| 选项 | 操 作 | 现 象 | 结 论 |
| A | 向 3ml0.1mol/L 的 AgNO3 溶液中先加 入 4—5 滴 0.1mol/L 的 NaCl 溶液,再滴加 4—5 滴 0.1mol/L 的 NaI 溶液 | 先出现白色沉 淀后出现黄色 沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 将某气体通入品红溶液 | 品红溶液褪色 | 该气体是 SO2 |
| C | 用 pH 计测定等浓度的 Na2CO3 和NaClO 溶液的 pH | 后者 pH比前者 的小 | 非金属性:Cl>C |
| D | 将铜粉加入 1.0 mol/L Fe2(SO4)3 溶液中 | 溶液变蓝 | 氧化性Fe3+>Cu2+ |
 SO3
SO3  H2SO4
B . Si
H2SO4
B . Si  SiO2
SiO2  H2SiO3
C . NH3
H2SiO3
C . NH3  NO2
NO2  HNO3
D . Cl2
HNO3
D . Cl2  Br2
Br2  I2
I2
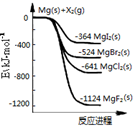
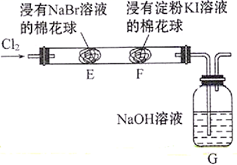
实验装置 | 选项 | 实验目的 | 试剂X | 试剂Y |
| A | 验证电石与饱和食盐水反应生成的乙炔的性质 | CuSO4溶液 | KMnO4溶液 |
B | 检验CH3CH2Br消去反应后的气体产物 | 水 | KMnO4溶液 | |
C | 验证苯和液溴在FeBr3的催化下发生取代反应 | CCl4溶液 | AgNO3溶液 | |
D | 验证氧化性Cl2>Br2>I2 | NaBr溶液 | 淀粉-KI溶液 |