氢氧化铝的制取和性质探究 知识点题库
以Al2O3为原料制取氢氧化铝,最好的方法是( )
A . 将Al2O3溶于水
B . 将Al2O3先溶于盐酸中,之后滴加氢氧化钠溶液
C . 将Al2O3先溶于盐酸中,之后滴加氨水
D . 将Al2O3先溶于NaOH溶液中,之后再滴加盐酸
向物质M的溶液中逐滴加入NaOH溶液,先产生白色沉淀,然后沉淀逐渐溶解,则物质M可能是( )
A . MgSO4
B . AlCl3
C . NaAlO2
D . FeCl3
将3mol/L
NaOH溶液滴入到25mL 一定浓度的AlCl3溶液中。下图是整个过程的数学分析曲线。其中横轴表示加入OH-的物质的量,纵轴表示产生的Al(OH)3沉淀的物质的量。据图回答:
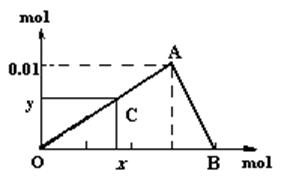
-
(1) 当C点从O点向A点运动时,表示随着OH-的不断加入,沉淀量逐渐。OA曲线表示的离子反应是:;由此可得A点的坐标为;此时加入氢氧化钠溶液的体积为;
-
(2) AB曲线表示的离子反应为:,由此可得B点的坐标为:。
-
(3) 由上述分析,可求得AlCl3溶液中Al3+离子的浓度为:mol/L。
-
(4) 当x=0.035时,铝元素在体系中的存在形式为,其物质的量为。
①Cu丝 ②Cl2 ③Al2(SO4)3溶液 ④蔗糖 ⑤浓硝酸⑥Ca(OH)2⑦NH4Cl⑧CO2 ⑨氨水
请用以上相应的数字编号和化学用语回答问题:
-
(1) 属于电解质的是;属于非电解质的是.
-
(2) 实验室制取氨气的化学反应方程式.
-
(3) 工业制漂白粉的化学反应方程式.
-
(4) 实验室制Al(OH)3的离子方程式
-
(5) ①和⑤的化学方程式并用双线桥标出电子转移.
一定条件下,通过单质间化合可得到的是( )
A . FeCl3
B . SO3
C . Al(OH)3
D . Fe(OH)3
W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )
A . 原子半径:  B . W与X只能形成一种化合物
C . Y的氧化物为碱性氧化物,不与强碱反应
D . W、X和Z可形成既含有离子键又含有共价键的化合物
B . W与X只能形成一种化合物
C . Y的氧化物为碱性氧化物,不与强碱反应
D . W、X和Z可形成既含有离子键又含有共价键的化合物
 B . W与X只能形成一种化合物
C . Y的氧化物为碱性氧化物,不与强碱反应
D . W、X和Z可形成既含有离子键又含有共价键的化合物
B . W与X只能形成一种化合物
C . Y的氧化物为碱性氧化物,不与强碱反应
D . W、X和Z可形成既含有离子键又含有共价键的化合物
最近更新



