常见气体的检验 知识点题库
①通入紫色石蕊试液中 ②闻气味 ③通入澄清石灰水中 ④通入品红溶液中 ⑤通入氯水中,再滴加Ba(NO3)2溶液。
-
(1) 写出下列各反应的化学方程式:
①纯净的A在B中安静地燃烧生成C: .
②将气体B通入到水中: .
③将气体B通入到NaOH溶液中: .
④将气体B通入到适量石灰乳中: .
-
(2) 把三种气体分别通入酸性硝酸银溶液中,出现白色沉淀的气体是 (用字母表示).
-
(3) 白色浑浊物D因具有漂白性又称为 , 该物质在空气中容易变质的原因为(用化学方程式表示)
如图是检验气体性质的一种实验装置,请回答:
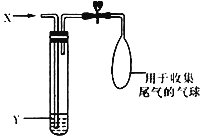
-
(1) 当X为二氧化硫气体时
①如果Y为滴有酚酞的稀氢氧化钠溶液,可观察到溶液褪色,此实验说明二氧化硫的水溶液具有 性;
②如果Y为品红溶液时,可观察到溶液褪色,此实验说明二氧化硫具有 性;
③如果Y为酸性KMnO4溶液时,也可观察到溶液褪色,此实验说明二氧化硫具有 性.
-
(2) 仍用如图所示装置进行下列各组实验,也能看到溶液褪色现象的是 (填序号).
A.X为甲烷,Y为酸性高锰酸钾溶液
B.X为氯气,Y为紫色石蕊试液
C.x为乙烯,Y为溴的四氯化碳溶液.
-
(1)
【提出猜想】
猜想1:
猜想2:
猜想3:
为了验证猜想,该小组设计实验加以探究.
【实验探究】该小组同学按如图所示装置,将气体从a端通入,则;

-
(2) B中应该装 试剂(填编号).
A . 氢氧化钠溶液 B . 酸性高锰酸钾溶液 C . 饱和碳酸钠溶液 D . 饱和碳酸氢钠 -
(3) A中品红溶液的作用是 .
-
(4) D中澄清石灰水的作用是 .
-
(5) 通过该实验,该小组同学观察到以下三个实验现象:
①A中品红溶液褪色 ②C中品红溶液不褪色 ③D中澄清石灰水变浑浊
【得出结论】由上述现象该小组同学确认该气体为 .
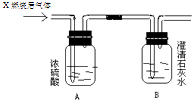
-
(1) 若A洗气瓶的质量增加,B洗气瓶的质量不变,则气体X是.
-
(2) 若A洗气瓶的质量不变,B洗气瓶的质量增加,则气体X是.
-
(3) 若A、B两个洗气瓶的质量都增加,则气体X可能是.

-
(1) 同学甲设计实验检验废气A中含有CO2 , 应选择的试剂有 .A . NaOH溶液 B . 酸性KMnO4溶液 C . 澄清石灰水 D . 盐酸
-
(2) 同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如TU装置进行实验.
①为了保证实验成功,装置A应具有的现象是,搅拌的目的是.
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算.经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是.
①原气体中肯定有SO2
②原气体中可能有SO2
③原气体中肯定无H2S、HBr
④不能肯定是否含有HCl
⑤原气体中肯定不含CO2
⑥原气体中肯定含HCl.

-
(1) 写出N2的电子式;将空气中的氮气转化为含氮化合物的过程称为固氮,当今大规模人工固氮的主要方法是(用化学方程式表示)。
-
(2) 某无色混合气体中可能含有NH3、O2、H2、NO、HCl等气体,将它通过浓H2SO4 后发现气体体积减少,将剩余气体与空气接触后呈红棕色,此混合气中一定不含有。
-
(3) 实验室有多种制取氨气的方法,其中加热消石灰与氯化铵的混合固体就是方法之一。
①写出此反应的化学方程式:。
②氨气可使湿润的红色石蕊试纸变蓝的原因(用相应的方程式说明)。
③用乙装置(见图)吸收一段时间氨气后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,锥形瓶中不可能生成的物质是(选填序号)。

a H2 b NO2 c HNO3 d NH4NO3
写出乙装置中氨催化氧化的化学方程式:。
-
(4) 已知3Cl2+2NH3=N2 + 6HCl,若NH3过量则还有反应:NH3+ HCl= NH4Cl 。常温常压下,若在一密闭容器中将15mLCl2和40mL NH3充分混合反应后,剩余气体的体积为mL。
-
(1) 用如图所示实验装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”(石棉绒是耐高温材料,不与水反应)。
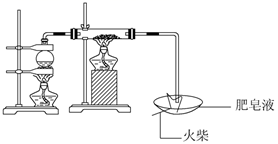
反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当肥皂泡爆破,并有爆鸣声时,说明“铁与水蒸气”能够进行反应,写出铁与水蒸气反应的化学方程式。
-
(2) 为了研究(1)中一定时间内铁粉的消耗量,他们设计了如下实验:准确称量一定质量的铁粉进行反应,收集并测量反应后生成的气体体积(已折算成标准状况)。
①收集并测量气体体积应选下图中的装置。
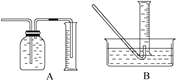
②称取0.24 g铁粉与适量石棉绒混合,然后加热至无气体放出。最好选用规格的量筒(选填字母序号)。
A.100 mL B.200 mL C.500 mL D.1 000 mL
-
(3) 现有NaHCO3和Na2CO3·xH2O的混合物,为了测定x值,某同学采用如图所示的装置进行实验(CaCl2、碱石灰均足量)。
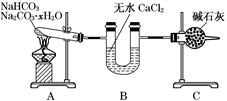
①若在装置A的试管中装入NaHCO3和Na2CO3·xH2O的混合物3.7 g,用酒精灯加热到反应完全,此时B管增重1.89 g,C管增重0.22 g,则x的值为。
②该装置还不是很完善,可能使测定结果偏小,应如何改进。原因是。

下列说法正确的是( )
选项 | 操作或做法 | 目的 |
A | 在过氧化氢溶液中加入少量 | 加快 |
B | 用铂丝蘸取某溶液进行焰色反应,火焰呈黄色 | 证明该溶液溶质为钠盐 |
C | 向稀盐酸中加入锌粒,将生成的气体通过浓硫酸 | 制取纯净的 |
D | 用湿润的淀粉碘化钾试纸检验某气体,试纸变蓝 | 证明该气体为 |

 的生成速率
的生成速率




