常见气体的检验 知识点题库
-
(1)
实验室制备原料气NO和Cl2的装置如下图所示:
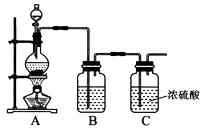
①实验室制NO时,装置A中烧瓶内发生反应的化学方程式为。
②实验室制Cl2时,装置B中盛放的试剂为,其作用是。
-
(2)
将上述收集到的Cl2充入集气瓶中,按图示装置制备亚硝酰氯。
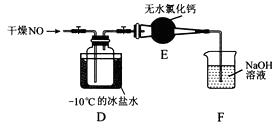
①NOCl分子中各原子均满足8电子稳定结构,则NOCl的电子式为。
②装置D中的现象为。
③装置E中无水氯化钙的作用为。
④某同学认为装置F不能吸收NO,为解决这一问题,可将尾气与某种气体同时通入氢氧化钠溶液中,这种气体的化学式是。
-
(3)
NO可用间接电化学法除去,其原理如下图所示:
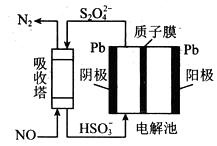
①阴极的电极反应式为。
②吸收塔内发生反应的离子方程式为。
选项 | 操作 | 现象 | 结论 |
A | 向溶有SO2的BaCl2溶液中通入气体X | 产生白色沉淀 | X一定是NO2 |
B | 向NaAlO2溶液中滴入NaHCO3溶液 | 产生白色沉淀 | AlO2-结合H+能力比CO32-强 |
C | 向NaHCO3溶液中加入醋酸,将产生的气体 直接通入苯酚钠溶液中 | 产生白色沉淀 | 酸性:醋酸>碳酸>苯酚 |
D | 浓度均为0.10mol/L的 Na2CO3和Na2S的混合溶液中滴入少量AgNO3溶液 | 产生黑色沉淀 | Ksp(Ag2S)>Ksp(Ag2CO3) |
| 选项 | 实验操作和现象 | 结论 |
| A | 将湿润的红色石蕊试纸置于集气瓶口,试纸变蓝 | 集气瓶内的气体为NH3 |
| B | 常温时向盛有浓硝酸的两支试管中分别投入铜片与铁片后,铜片逐渐溶解而铁片不溶解 | 金属性:Cu > Fe |
| C | 向鸡蛋清溶液中加入少量CuSO4溶液,出现浑浊,分离沉淀后加足量水,沉淀不溶解 | 蛋白质发生了变性 |
| D | 向某乙醇中加入一小块金属钠,有气泡生成 | 该乙醇中含有一定量的水 |
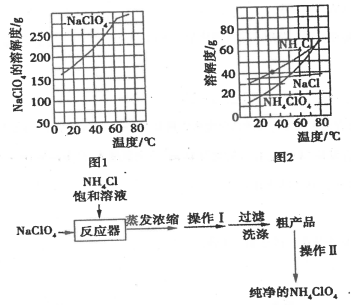
-
(1) 反应器中发生反应的基本反应类型是。
-
(2) 上述流程中由粗产品获得纯净高氯酸铵的方法为。
-
(3) 洗涤粗产品时,宜用(填“0℃冷水”或“80℃热水”)洗涤。
-
(4) 已知NH4ClO4在400℃时开始分解为N2、Cl2、H2O。某课题组设计实验探究NH4ClO4的分解产物(假设装置内药品均足量,部分夹持装置已省略)
实验开始前,已用CO2气体将整套实验装置中空气排尽;焦性没食子酸溶液用于吸收氧气。
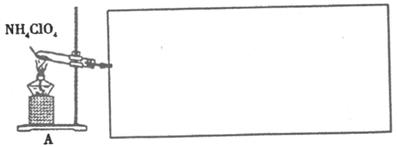
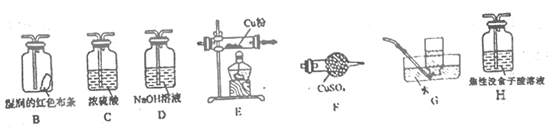
①写出高氯酸铵分解的化学方程式 。
②为了验证上述产物,按气流从左至右,装置的连接顺序为A→(填装置对应的字母),证明氧气存在的实验现象为 。
③若装置E硬质玻璃管中的Cu粉换成Mg粉,向得到的产物中滴加蒸馏水,产生使湿润的红色石蕊试纸变蓝的气体。滴加蒸馏水发生反应的化学方程式为。
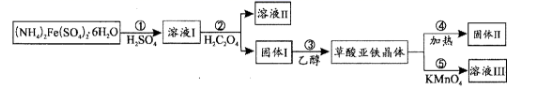
已知:常温下,pH>4时,Fe2+容易被氧化;H2C2O4的Ka1=5.9×10-2 , Ka2=6.5×10-5;Ksp(FeC2O4•xH2O)=3.2×10-7
回答下列问题:
-
(1) 步骤①用水溶解的过程中,加入少量稀H2SO4的作用是。
-
(2) 步骤②中加入的H2C2O4属于酸,生成固体I的离子反应方程式为。
-
(3) 步骤③中先用水洗涤,再用乙醇洗涤,其目的是。
-
(4) 步骤④是检验草酸亚铁晶体加热分解后的产物H2O、CO、CO2 , 首先检验的气体为,然后将剩余气体依次通过(填序号,装置可重复使用)→尾气处理。实验前需要将装置中的空气排尽,理由是。
-
(5) 步骤⑤采用滴定分析法测定FeC2O4•xH2O中x的值。取0.18g样品溶于稀硫酸配成100.00mL溶液,取20.00mL于锥形瓶中,用0.0100mol•L-1KMnO4溶液滴定至终点,消耗KMnO4溶液12.00mL。滴定终点的现象为,x值为。
| 选项 | 实验目的 | 实验方案 |
| A | 探究化学反应的 限度 | 取5mL0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5~6滴,充分反应,可根据溶液中既含I2又含I-的实验事实判断该反应是可逆反应 |
| B | 探究浓度对化学反应速率的影响 | 用两支试管各取5mL0.1mol/L的KMnO4溶液,分别加入2mL0.1mol/L和0.2mol/L的草酸溶液,记录溶液褪色所需的时间 |
| C | 证明溴乙烷的消去反应有乙烯生成 | 将NaOH的乙醇溶液加入溴乙烷中加热,将产生的气体直接通入酸性KMnO4溶液中 |
| D | 验证醋酸钠溶液中存在水解平衡 | 取CH3COONa溶液于试管中并加入几滴酚酞试剂,再加入醋酸铵固体其水溶液呈中性,观察溶液颜色变化 |
①用剩的药品为避免浪费应放回原瓶
②蒸发氯化钠溶液时要用玻璃棒不断搅拌
③称取易潮解的药品必须放在玻璃器皿中称量
④用试纸检验气体性质时,手拿着试纸经水润湿后靠近气体观察试纸颜色变化
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向淀粉水解液中加入过量NaOH溶液,再加入碘水 | 溶液未变蓝色 | 证明淀粉已完全水解 |
| B | 乙醇浓硫酸混合加热,将产生的气体通入酸性高锰酸钾溶液 | 紫红色褪去 | 证明有乙烯生成 |
| C | 向苯中加入少量液溴 | 橙色褪去 | 证明生成溴苯 |
| D | 向浅蓝色硫酸铜溶液中滴入足量浓氨水 | 溶液最终变为深蓝色 | 证明有硫酸四氨合铜生成 |
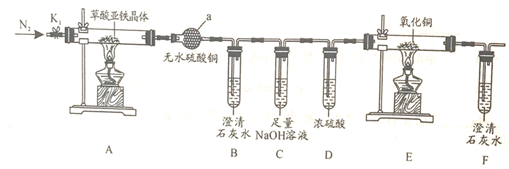
-
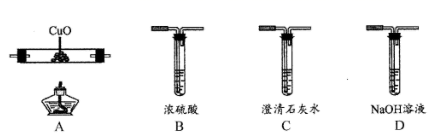
(1) 仪器a的名称是。
-
(2) 实验前先通入一段时间N2 , 其目的为。
-
(3) 实验证明了气体产物中含有CO,依据的实验现象为。
-
(4) 从绿色化学考虑,该套装置存在的明显缺陷是。
-
(5) 草酸亚铁晶体在空气易被氧化,请设计方案检验草酸亚铁晶体是否氧化变质。
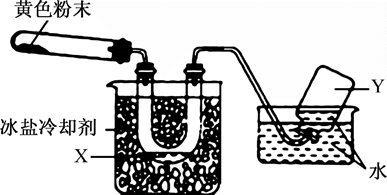
| 选项 | 气体 | 液体 | 喷泉颜色 |
| A | Cl2 | 饱和食盐水 | 黄绿色喷泉 |
| B | NH3 | 含有酚酞的H2O | 红色喷泉 |
| C | HCl | AgNO3溶液 | 白色喷泉 |
| D | CO2 | 含有酚酞的NaOH溶液 | 红色喷泉 |
 、NO、
、NO、 、
、 、
、 、
、 中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则有关甲气体的组成判断不正确的为(不考虑
中的几种,将100mL甲气体经过如图所示的实验装置进行处理,结果得到酸性溶液,而几乎无气体剩余,则有关甲气体的组成判断不正确的为(不考虑 与
与 、NO的反应)( )
、NO的反应)( )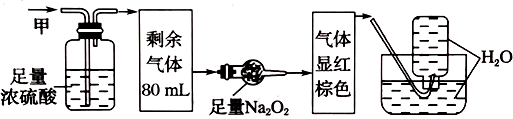
 、
、 、
、 B . 一定含
B . 一定含 , 其体积为20mL
C . 一定含
, 其体积为20mL
C . 一定含 , 其体积为48mL
D . 一定含NO,其体积为20mL
, 其体积为48mL
D . 一定含NO,其体积为20mL
请回答下列问题:
-
(1) 三草酸合铁酸钾在一定条件下能分解产生CO2和CO两种气体。某化学小组设计了如图所示的装置(夹持装置等略去),来验证这两种气体产物。
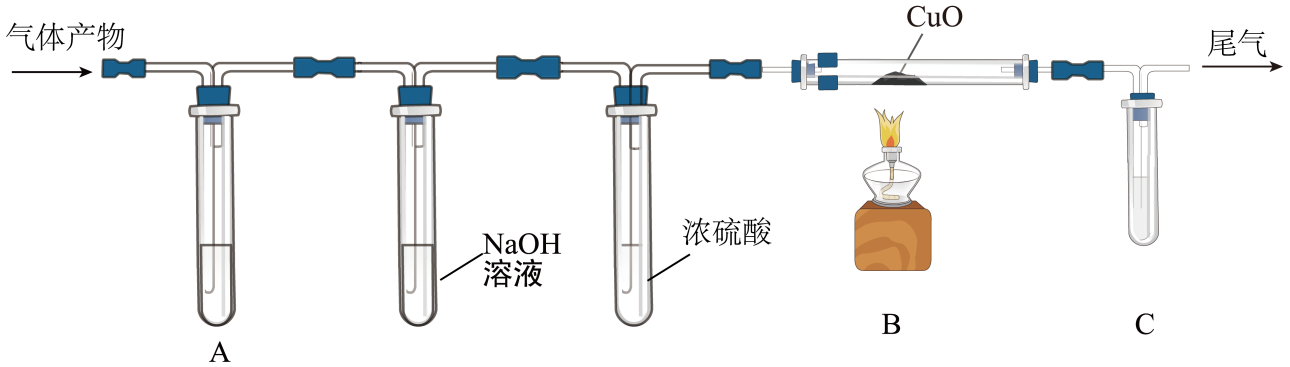
则A、C装置中的试剂均为;NaOH溶液的作用是;B装置硬质玻璃管中反应的化学方程式为;实验前需先通入N2排除装置内的空气,其原因是。
-
(2) 实验室制备三草酸合铁酸钾的操作如下:称取5g(NH4)2Fe(SO4)2·6H2O固体置于烧杯中,加入15mL水和几滴稀硫酸,搅拌充分溶解。再加入25mL饱和H2C2O4溶液,加热至沸,生成黄色沉淀FeC2O4·2H2O。静置,倾去上层清液,将沉淀洗涤干净,向其中加入过量饱和K2C2O4溶液,水浴加热至40℃,边搅拌边缓慢滴加H2O2溶液,沉淀逐渐变为红褐色。将混合物继续煮沸,加入饱和H2C2O4溶液,红褐色沉淀溶解,趁热过滤。待滤液冷却后,析出亮绿色晶体,过滤、洗涤、干燥,可得到产品。则加入稀硫酸的作用是;滴加H2O2溶液生成K3[Fe(C2O4)3]和红褐色沉淀的化学方程式为;红褐色沉淀溶解得到K3[Fe(C2O4)3]的化学方程式为;滴加H2O2溶液时混合物的温度不宜过高的原因是;过滤操作中需用到的玻璃仪器有(写出2种即可)。



