常见气体的检验 知识点题库
检验SO2中是否混有CO2气体,可采用的方法是( )
A . 通过品红溶液
B . 先通过NaOH溶液,再通过澄清石灰水
C . 通过澄清石灰水
D . 先通过KMnO4酸性溶液,再通过澄清石灰水
实验室有一气体样品,可能含有NO2、NH3、O2和CO2中的一种或多种.下列根据实验事实得出的结论正确的是( )
A . 将集有气体样品的试管倒扣于水槽中,试管中液面上升,则原气体样品中一定含NH3
B . 将带火星的木条伸入盛满气体样品的集气瓶中,木条未复燃,则原气体样品中一定不含O2
C . 将一定体积气体样品缓缓通入澄清石灰水中,未见有白色沉淀,则原气体样品中一定不含CO2
D . 将一定体积气体样品缓缓通入水中,恰好完全反应生成一种盐,向所得盐溶液中加入澄清石灰水,未见沉淀生成,则原气体样品中V(NH3):V(O2)=4:1
一定条件下,将0.1LCO、0.2LCO2、0.1LNO、0.2LNO2和0.2LNH3混合,然后通过分别盛有足量蒸馏水、饱和碳酸氢钠溶液和氢氧化钠溶液的三个洗气瓶(洗气瓶排列顺序不确定).假设气体通过每个洗气瓶都能充分反应,则尾气(已干燥)( )
A . 可能是单一气体,也可能存在原气体中的两种气体
B . 可能含有也可能不含一氧化碳
C . 无论顺序如何,各瓶增重相同
D . 成分和洗气瓶的排列顺序无关
)混合气体,可能含有下列气体中的某几种:NH3、O2、NO、Cl2、HCl,在温度和压强不变的情况下进行如下实验,写出每步可以肯定的结论:
实 验 现 象 | 可 以 肯 定 的 结 论 |
A、观察混合气体无色 | 无 、 |
B、将混合气体通过浓H2SO4 , 体积减小 | 有 、无 |
C、剩余气体跟空气接触后变为红棕色 | 有 、无 |
有一无色气体,可能含有HCl,NH3 , NO,CO2 , O2中的一种或几种.将其通入酸性AgNO3溶液中,有白色沉淀生成;与空气接触呈红棕色,则原气体中一定有 ;一定没有 ;不能确定的是 .
下列关于物质或离子检验的叙述正确的是( )
A . 在溶液中加KSCN,溶液显红色,证明原溶液中有Fe3+ , 无Fe2+
B . 气体通过无水CuSO4 , 粉末变蓝,证明原气体中含有水蒸气
C . 灼烧白色粉末,火焰呈黄色,证明原粉末中有Na+ , 无K+
D . 将气体通入澄清石灰水,溶液变浑浊,证明原气体是CO2
下列有关实验的叙述,正确的是( )
A . 将固体加入容量瓶中溶解并稀释至刻度,配置成一定物质的量浓度的溶液
B . 某溶液与BaCl2溶液反应生成白色沉淀,说明原溶液中有SO42﹣
C . 用NaOH溶液洗涤并灼烧铂丝后,再进行焰色反应
D . 可以用湿润的红色石蕊试纸检验是否有氨气生成
检验氯化氢气体中是否混有Cl2 , 可采用的方法是( )
A . 用干燥的蓝色石蕊试纸
B . 用干燥有色布条
C . 用湿润的淀粉碘化钾试纸
D . 将气体通入硝酸银溶液
草酸亚铁晶体(FeC2O4·2H2O)是一种淡黄色粉末,某课外小组利用下列装置检验草酸亚铁晶体受热分解的部分产物。

下列说法正确的是( )
A . 若③和⑤中分别盛放足量NaOH溶液和CuO,可检验生成的CO
B . 实验时只需要在装置①中反应结束后再通入N2
C . 若将④中的无水CaCl2换成无水硫酸铜可检验分解生成的水蒸气
D . 实验结束后,①中淡黄色粉末完全变成黑色,则产物一定为铁
-
(1) 配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果。(填“偏大”、“偏小”、或“不变”)
-
(2) 从石油中分离出汽油、煤油和柴油等,所采用的方法是。(填“干馏”或“分馏”)
-
(3) 除去二氧化碳气体中的氯化氢杂质,选用的试剂是。(填“NaOH溶液”或“饱和NaHCO3溶液”)
-
(4) 如图是实验室制取氨气的装置,回答下列问题:
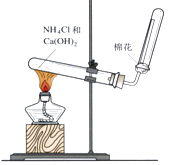
①收集氨气的方法是排空气法。
②验证氨气是否收集满的方法是。
草酸(乙二酸)存在于自然界的植物中,其K1=5.4×10﹣2 , K2=5.4×10﹣5 . 草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水.草酸晶体(H2C2O4•2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解.回答下列问题:

-
(1) 甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是,由此可知草酸晶体分解的产物中有.装置B的主要作用是。
-
(2) 乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验.

①乙组同学的实验装置中,依次连接的合理顺序为A、B、装置H反应管中盛有的物质是。
②能证明草酸晶体分解产物中有CO的现象是
-
(3) ①设计实验证明:
①草酸的酸性比碳酸的强
②草酸为二元酸
既可以用来鉴别乙烷和乙烯,又可以用来除去乙烷中混有的少量乙烯的操作方法是( )
A . 向混合气体中通入一定量的氢气
B . 将混合气通过盛酸性高锰酸钾溶液的洗气瓶
C . 将混合气通过盛蒸馏水的洗气瓶
D . 将混合气通过盛足量溴水的洗气瓶
气体X可能由NH3、Cl2、H2S、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生淡黄色的沉淀,该沉淀不溶于稀硝酸。若将X通入澄清的石灰水中,却不见沉淀产生。则有关气体X的成分的下列说法正确的是( )
①一定含有HBr,可能含有CO2 ②一定不含CO2
③一定不含NH3、Cl2、H2S ④可能含CO2、Cl2
A . 只有①
B . 只有③
C . ①和③
D . ②和③
请用如下图所示仪器设计一个电解饱和食盐水并测定电解时产生的H2的体积和检验Cl2的实验装置。(提示:Cl2可与KI反应生成I2 , I2遇淀粉变蓝)

-
(1) 仪器连接时,各接口的顺序是(填字母代号):A接、接;B接、接。
-
(2) 证明产物Cl2的实验现象是。
-
(3) 实验测得产生的氢气体积(已折算成标准状况)为11.2mL,电解后溶液的体积恰好为50.0mL,则溶液中NaOH的物质的量浓度为。
可以用于鉴别CO2和SO2的试剂是( )
A . 澄清石灰水
B . 紫色石蕊试液
C . 品红溶液
D . Ba(OH)2
一瓶无色气体,可能含有HCl、H2S、SO2、HBr、NO2、CO2中的一种或几种,将其通入氯水中,得无色透明溶液,将该溶液分成两份,一份加盐酸酸化的BaCl2溶液,析出白色沉淀;另一份加硝酸酸化的硝酸银溶液,也有白色沉淀生成。下面结论正确是( )
①原气体中肯定有SO2 ②原气体中可能有SO2 ③原气体中肯定无H2S、HBr、NO2④不能肯定是否含有HCl ⑤原气体中肯定不含CO2 ⑥原气体中肯定含HCl
A . ①③④
B . ①④⑤
C . ①③⑥
D . ①③④⑤⑥
用下列装置完成相关实验,合理的是( )

A . 图①:验证H2CO3的酸性强于H2SiO3
B . 图②:收集CO2或NH3
C . 图③:分离Na2CO3溶液与CH3COOC2H5
D . 图④:分离CH3CH2OH与CH3COOC2H5
下列实验现象与结论均正确的是( )

A . A
B . B
C . C
D . D
下列说法错误的是( )
A . 升高温度可加快H2O2的分解速率
B . 减小H2O2溶液浓度可降低其分解速率
C . 加FeCl3不能加快H2O2分解速率
D . 用带火星的木条可检验H2O2分解产生的气体
在实验室制取乙烯时,其反应为  ,该实验常因温度控制不当而发生副反应生成
,该实验常因温度控制不当而发生副反应生成  、
、  、水蒸气等。实验室设计如下图实验装置以验证上述反应生成的混合气体中含乙烯、
、水蒸气等。实验室设计如下图实验装置以验证上述反应生成的混合气体中含乙烯、  和水蒸气。
和水蒸气。
 ,该实验常因温度控制不当而发生副反应生成
,该实验常因温度控制不当而发生副反应生成  、
、  、水蒸气等。实验室设计如下图实验装置以验证上述反应生成的混合气体中含乙烯、
、水蒸气等。实验室设计如下图实验装置以验证上述反应生成的混合气体中含乙烯、  和水蒸气。
和水蒸气。 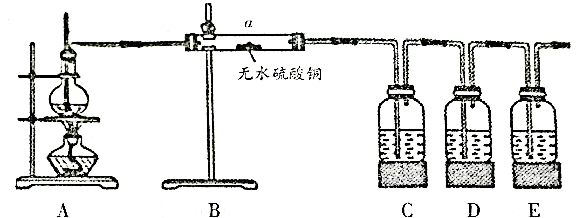
限用试剂:乙醇、浓硫酸、品红溶液、氢氧化钠溶液、酸性高锰酸钾溶液、溴水。
-
(1) 仪器a的名称为。
-
(2) 请根据实验的要求完成下列填空:
①C中试剂为。
②D中的试剂作用为。
③E中的试剂为,其作用为。
-
(3) 简述装置B置于装置A、C之间的理由:。
最近更新



