物质检验实验方案的设计 知识点题库
①取少量的溶液用硝酸酸化后,加Ba(NO3)2溶液,无沉淀生成.
②另取少量溶液逐滴加入盐酸,其现象是:一段时间保持原样后,开始产生沉淀并逐渐增多,沉淀量基本不变后产生一种气体,最后沉淀逐渐减少至消失.
-
(1) 原溶液中肯定存在的离子是,肯定不存在的离子是.
-
(2) 已知一定量的原溶液中加入5mL 0.2mol/L盐酸时,沉淀会完全消失,加入足量的硝酸银溶液可得到沉淀0.187g,则原溶液中是否含有Cl﹣?.
-
(3) 按照反应顺序逐步书写出②中发生反应的离子反应方程式
①H++OH﹣=H2O
②
③
④HCO3﹣+H+=H2O+CO2↑
⑤ .
①向其中加入过量盐酸,有气体生成,并得到无色透明溶液;
②在①所得溶液中加入过量氢氧化钡溶液,产生白色沉淀,过滤;
③在②所得的滤液中加入过量稀硝酸,再加入硝酸银溶液,产生白色沉淀.
根据上述实验回答下列问题:
-
(1) 原溶液中一定不存在的离子是;
-
(2) 原溶液中一定存在的离子是;
-
(3) 原溶液中可能存在的离子是,
-
(4) 请写出①和③中发生反应的离子方程式、.
-
(1) NaHSO4在水中会解离出Na+、H+、SO42﹣ . 从物质分类的角度考虑,NaHSO4属于A . 酸 B . 碱 C . 盐 D . 氧化物
-
(2) 最先检验出来的固体物质是,利用它又可直接检验出的固体物质是.
-
(3) 剩余两种固体被检验出来时发生反应的化学方程式分别是:、.
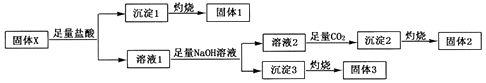
实验结束后得到15.3g固体2和6.0g固体3,且固体1、固体2、固体3都可用作耐高温材料.回答下列问题:
-
(1) NaOH的电子式为,沉淀2的化学式为.
-
(2) 固体X的化学式为.
-
(3) 溶液1中加入足量NaOH溶液反应的离子方程式为.
-
(4) 在高温下,固体3中某元素的单质可以与固体1发生置换反应,请写出此反应的化学方程式.
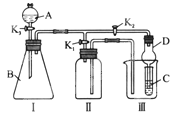
阳离子 | K+、NH4+、H+、Ba2+ |
阴离子 | Cl-、CO32-、SO42-、OH- |
现取三份上述澄清溶液各100 mL,分别进行以下实验:
①第一份加入AgNO3溶液有沉淀产生;
②第二份加入足量NaOH溶液加热后,收集到气体0.04 mol;
③第三份加入足量BaCl2溶液后,得干燥沉淀6.27 g,经足量盐酸洗涤,干燥后,沉淀质量为2.33 g。
请回答下列问题:
-
(1) 100 mL溶液中c(SO42-)=。
-
(2) 第二份加入NaOH溶液产生气体的离子方程式。
-
(3) 6.27 g沉淀的成分是 (用化学式表示)。
-
(4) 上述澄清溶液中除SO42-以外,一定大量存在的离子是。
操作及现象 | 结论 | |
A | 某溶液中加入盐酸,产生能使澄清石灰水变浑浊的无色无味气体 | 溶液中一定含有CO32- |
B | 某溶液中加入硝酸银,产生白色沉淀 | 溶液中一定含有Cl- |
C | 用洁净铂丝蘸取某溶液在火焰上灼烧,火焰呈黄色 | 溶液中有Na+ , 无K+ |
D | 向某溶液中先加几滴KSCN溶液,无明显现象,再滴氯水,溶液变红 | 溶液中一定含有Fe2+ |
-
(1) 测得0.1mol/L的Na2SO3溶液pH=11,其原因是(用离子方程式解释)
-
(2) 调节pH,对两者的反应进行了如下实验并记录了实验现象(实验都在锥形瓶中完成,且所用锥形瓶均进行振荡)
实验
pH
实验现象
①
10
产生白色沉淀,稍后溶解,溶液澄清
②
6
产生白色沉淀,放置长时间后无变化
③
2
产生白色沉淀,一段时间后,变为棕黑色海绵状沉淀X
已知:
A.Ag2SO3:白色不溶于水,能溶于过量Na2SO3溶液
B.Ag2SO4:白色微溶于水,只能溶于浓硝酸
C.Ag2O:棕黑色,能与酸反应
①根据以上信息,解释实验1中白色沉淀溶解可能的原因
②甲同学对于实验2中的白色沉淀的成分,提出如下猜想
猜想1:白色沉淀为Ag2SO3
猜想2:白色沉淀为Ag2SO4
猜想3:白色沉淀中既有Ag2SO3也有Ag2SO4
为了证明其猜想,甲同学过滤实验2中的白色沉淀,加入溶液,发现白色沉淀部分溶解;再将剩余固体过滤出来,加入溶液,沉淀完全溶解,由此证明猜想3成立。
-
(3) 乙同学为了确定实验3中棕黑色沉淀X的成分,做了如下实验
①向X中加入稀盐酸,无明显变化
②向X中加入过量浓硝酸,有红棕色气体生成
③分别用Ba(NO3)2溶液和BaCl2溶液检验实验②反应后的溶液,发现前者无变化,后者产生白色沉淀,其中,实验①的目的为,由上述实验现象可确定沉淀X的成分为(填化学式),实验②的化学方程式为。
| 选项 | 实验目的 | 实验操作及现象 |
| A | 证明钠与水的反应放热 | 将钠投入水中,剧烈反应,钠熔化成闪亮的小球,四处游动 |
| B | 证明敞口放置的亚硫酸钠溶液已部分变质 | 向试样中滴加BaCl2 溶液,有白色沉淀生成 |
| C | 证明氧化铝的熔点高于铝 | 将用砂纸打磨过的铝箔放在酒精灯上灼烧,铝箔熔化而不滴落 |
| D | 证明蛋白质溶液属于胶体 | 用激光照射蛋白质溶液,侧面能看到光亮的通路 |
| 选项 | ① | ② | ③ | 实验结论 | |
| A | 浓硫酸 | Na2SO3 | KMnO4 溶液褪色 | SO2有漂白性 | |
| B | 浓盐酸 | KMnO4 | FeBr2溶液变为黄色 | 氧化性:Cl2>Br2 | |
| C | 稀硫酸 | 碳酸钠 | CaCl2溶液无明显变化 | CO2不与CaCl2反应 | |
| D | 浓硫酸 | 蔗糖 | 溴水褪色 | 浓硫酸具有脱水性、吸水性 |
-
(1) I.化学试剂的妥善保存十分重要。共价化合物A由三种常见的短周期元素组成,常温常压下是一种有特殊气味的无色液体,易与强氧化剂反应,实验室必须密封避光保存。按以下流程进行实验(以下反应都为充分反应、气体F溶于水部分忽略不计):
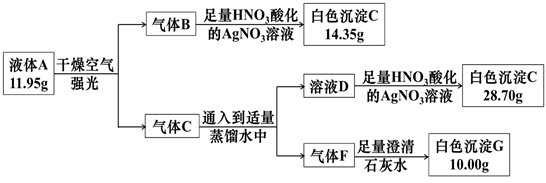
组成A的元素的元素符号为;G的化学式为。
-
(2) 液体A反应生成B和C的化学方程式为。
-
(3) 保存A时常加入1%的乙醇来破坏A被氧化生成的剧毒物质C。请写出C与乙醇反应生成碳酸二乙酯的化学方程式。
-
(4) II.Na2S2O3 , 又名大苏打、海波,可用以除去自来水中的多余氯气。在实验室可以用新制氯水模拟含多余氯气的自来水,向新制氯水中滴入Na2S2O3溶液。
新制氯水与Na2S2O3溶液反应的离子方程式为。
-
(5) 新制氯水中的氯气被全部除尽后,如果继续滴入Na2S2O3溶液有可能产生的现象:。
 ClCH2COOH+HCl
ClCH2COOH+HCl
已知:
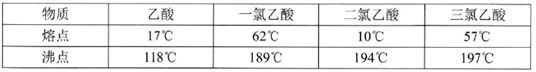
请回答下列问题:
-
(1) 将18.0 g乙酸放入三颈烧瓶中,并加入适量的硫做催化剂,并选用下图的装置制备一氯乙酸粗品。
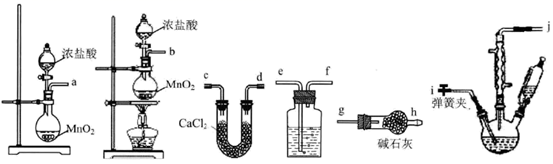
①按照气流从左至右依次连接的合理顺序为→→→→i→j→g→h(填接口字母)。
②实验室里也可使用高锰酸钾与浓盐酸反应制取Cl2 , 其反应的化学方程式为。
③洗气瓶中的溶液为,碱石灰的作用是。
-
(2) 制备一氯乙酸时,首先采用(填“水浴”、“油浴”或“沙浴”)加热方法控制温度在95℃左右,待温度稳定后,再打开弹簧夹,然后打开活塞滴加浓盐酸并点燃酒精灯,如果三颈烧瓶溶液表面观察到大量黄绿色气体时,应该(填操作),以减少氯气通入量,以免浪费。
-
(3) 一氯乙酸粗品中含有二氯乙酸、三氯乙酸,多次蒸馏后产品中仍含有杂质,杂质中含量较多的是(填物质名称),经提纯后得到纯净的一氯乙酸14.6 g,则一氯乙酸的产率为(精确到小数点后一位)。

 I2+I-
D . 向0.1mol/L ZnSO4溶液中滴加Na2S溶液至不再有白色沉淀生成,再滴加少量0.1mol/L CuSO4溶液,产生黑色沉淀,证明Ksp(ZnS)<Ksp(CuS)
I2+I-
D . 向0.1mol/L ZnSO4溶液中滴加Na2S溶液至不再有白色沉淀生成,再滴加少量0.1mol/L CuSO4溶液,产生黑色沉淀,证明Ksp(ZnS)<Ksp(CuS)
 , 主要可用于化学平衡问题的研究
D . 无水
, 主要可用于化学平衡问题的研究
D . 无水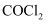 和无水硫酸铜均可以检验某气体是否潮湿
和无水硫酸铜均可以检验某气体是否潮湿
选项 | 实验目的 | 实验操作及现象 | 结论 |
A | 检验乙醇中是否含有水 | 向乙醇中加入一块绿豆大的钠,产生无色气体 | 乙醇中含有水 |
B | 检验石蜡油受热分解产生不饱和烃 | 对石蜡油加强热,将产生的气体通入 | 气体中含有不饱和烃 |
C | 证明氯乙烯加聚是可逆反应 | 加热试管中的聚氯乙烯薄膜碎片,试管口润湿的蓝色石蕊试纸变红 | 氯乙烯加聚是可逆反应 |
D | 检验蔗糖是否水解 | 向蔗糖溶液中滴加稀硫酸,水浴加热一段时间后,加入新制的 | 蔗糖未发生水解 |
实验操作 | 实验现象 | 实验结论 | |
A | 将水滴入盛有 | 观察到有气泡产生,木条复燃 |
|
B | 在100mL小烧杯中加入 | 液体呈红褐色 | 实验制得了 |
C | 将铂丝放在酒精灯外焰上灼烧,至与原来的火焰颜色相同。用铂丝蘸取某无色溶液,在外焰上灼烧 | 火焰呈黄色 | 溶液中含 |
D | 向盛有 | 有红色固体析出 |
|

 的
的 溶液中,溶液红棕色褪去
溶液中,溶液红棕色褪去 悬浊液,加热,无砖红色沉淀
悬浊液,加热,无砖红色沉淀 固体的试管中,立即把带火星的木条放在试管口
固体的试管中,立即把带火星的木条放在试管口
 稀溶液,加热至沸腾,向其中慢慢滴入5~6滴氯化铁饱和溶液,继续煮沸片刻,停止加热
稀溶液,加热至沸腾,向其中慢慢滴入5~6滴氯化铁饱和溶液,继续煮沸片刻,停止加热 胶体
胶体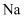 元素,不含K元素
元素,不含K元素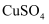 溶液的试管中加入铁粉
溶液的试管中加入铁粉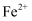 的氧化性强于
的氧化性强于 的氧化性
的氧化性


