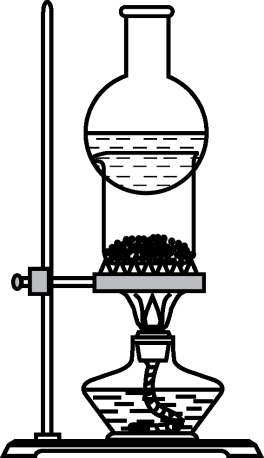
уЅЕУ┤еТБђжфїт«ъжфїТќ╣ТАѕуџёУ«ЙУ«А уЪЦУ»єуѓ╣жбўт║Њ
т╝║жЁИТђДТ║ХТХ▓XСИГтЈ»УЃйтљФТюЅNa+сђЂK+сђЂNH4+сђЂFe2+сђЂAl3+сђЂCO32№╣БсђЂSO32№╣БсђЂSO42№╣БсђЂCl№╣Б СИГуџёУІЦт╣▓уДЇ№╝їТЪљтљїтГдСИ║С║єуА«У«цтЁХТѕљтѕє№╝їтЈќXТ║ХТХ▓У┐ЏУАїУ┐ъу╗Гт«ъжфї№╝їт«ъжфїУ┐ЄуеІтЈіС║ДуЅЕтдѓСИІ№╝џ

СИІтѕЌу╗ЊУ«║ТГБуА«уџёТў»№╝ѕ №╝Ѕ
РЉаAgNO3Т║ХТХ▓ РЉАNaOHТ║ХТХ▓ РЉбТ░┤ РЉБТиђу▓Ѕ№╣БKIТ║ХТХ▓ РЉцFeCl2СИјKSCNТиитљѕТХ▓ РЉЦNaBrТ║ХТХ▓


-
№╝ѕ1№╝Ѕ тљФNH3сђЂNOxсђЂSO2уџёуЃЪТ░ћтюетцДТ░ћСИГуЏИС║њСйюуће№╝їС║ДућЪуџёжЏЙжюЙжбЌу▓њСИГТюЅтцџуДЇТЌаТю║уЏљ№╝їтЁХСИГТЌаТю║жЊхуЏљСИ╗УдЂТў»№╝ѕтАФтїќтГдт╝Ј№╝їтЈфтєЎСИцуДЇ№╝Ѕсђѓ
-
№╝ѕ2№╝Ѕ SO2тѓгтїќТ░ДтїќтЈЇт║ћ2SO2(g)+O2(g)
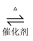 2SO3(g)уџёУЃйжЄЈСИјтЈЇт║ћУ┐ЏуеІтдѓтЏЙТЅђуц║№╝џ
2SO3(g)уџёУЃйжЄЈСИјтЈЇт║ћУ┐ЏуеІтдѓтЏЙТЅђуц║№╝џ 
РЉаУ»ЦтЈЇт║ћуџёТГБтЈЇт║ћСИ║уЃГ№╝ѕтАФРђюТћЙРђЮТѕќРђютљИРђЮ№╝ЅтЈЇт║ћсђѓ
РЉАУІЦУ»ЦтЈЇт║ћтюеТЂњТИЕТЂњт«╣т»єжЌГт«╣тЎеСИГУ┐ЏУАї№╝їУЃйУ»┤ТўјУ»Ц тЈЇт║ћти▓УЙЙтѕ░тїќтГдт╣│УААуіХТђЂуџёТў»№╝ѕтАФТаЄтЈи№╝Ѕсђѓ
A№╝јSO2уџёv(ТГБ)=v(жђє)
B№╝јТиитљѕТ░ћСйЊСИГтљїТЌХтГўтюеSO2сђЂO2сђЂSO3
C№╝јт«╣тЎетєЁТиитљѕТ░ћСйЊт»єт║дСИЇжџЈТЌХжЌ┤УђїтЈўтїќ
D№╝јт«╣тЎетєЁТиитљѕТ░ћСйЊТђ╗тјІт╝║СИЇтєЇжџЈТЌХжЌ┤УђїтЈўтїќ
-
№╝ѕ3№╝Ѕ Wang c HуГЅуаћуЕХтЈЉуј░ућеFe2O3/CeO2СйютѓгтїќтЅѓ№╝їтЈ»ућеС╣ЎуЃ»Уё▒жЎцуЃЪТ░ћСИГSO2т╣ХтЏъТћХтЇЋУ┤еуАФсђѓтЈЇт║ћтјЪуљєСИ║№╝џCH2№╝ЮCH2+3SO2
 3S+2CO2+2H2OсђѓТЪљтЁ┤УХБт░Ју╗ётљїтГдУ«ЙУ«Ат«ъжфїжфїУ»ЂУ»ЦтЈЇт║ћт╣ХТБђжфїС║ДуЅЕСИГуџёCO2 №╝ї т«ъжфїУБЁуй«№╝ѕтц╣ТїЂУБЁуй«ти▓уЋЦ№╝ЅтдѓтЏЙТЅђуц║№╝џ
3S+2CO2+2H2OсђѓТЪљтЁ┤УХБт░Ју╗ётљїтГдУ«ЙУ«Ат«ъжфїжфїУ»ЂУ»ЦтЈЇт║ћт╣ХТБђжфїС║ДуЅЕСИГуџёCO2 №╝ї т«ъжфїУБЁуй«№╝ѕтц╣ТїЂУБЁуй«ти▓уЋЦ№╝ЅтдѓтЏЙТЅђуц║№╝џ 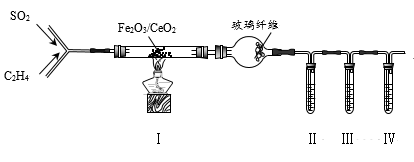
РЉат«ъжфїСИГТЅђжюђSO2тЈ»ућ▒CuСИјТхЊуАФжЁИтЈЇт║ћтѕХтЈќ№╝їУ»ЦтЈЇт║ћуџётїќтГдТќ╣уеІт╝ЈСИ║сђѓ
РЉАти▓уЪЦ№╝џжЁИТђДKMnO4тЈ»т░єCH2№╝ЮCH2Т░ДтїќСИ║CO2№╝ЏУБЁуй«РЁАсђЂРЁбСИГУ»ЋтЅѓтЮЄУХ│жЄЈ№╝ЏУБЁуй«№╝ѕРЁа№╝Ѕуџёт░ЙТ░ћСИГУ┐ўтљФТюЅТюфтЈЇт║ћуџёSO2тњїCH2№╝ЮCH2сђѓТБђжфїCO2ТЌХ№╝їРЁАсђЂРЁбсђЂРЁБСИГуЏЏТћЙуџёУ»ЋтЅѓСЙЮТгАтЈ»С╗ЦТў»№╝ѕтАФТаЄтЈи№╝Ѕсђѓ
A№╝јжЁИТђДKMnO4Т║ХТХ▓сђЂтЊЂу║бТ║ХТХ▓сђЂТЙёТИЁуЪ│уЂ░Т░┤
B№╝јNaOHТ║ХТХ▓сђЂжЁИТђДKMnO4Т║ХТХ▓сђЂТЙёТИЁуЪ│уЂ░Т░┤
C№╝јBr2уџёH2OТ║ХТХ▓сђЂтЊЂу║бТ║ХТХ▓сђЂТЙёТИЁуЪ│уЂ░Т░┤
D№╝јBr2уџёCCl4Т║ХТХ▓сђЂжЁИТђДKMnO4Т║ХТХ▓сђЂТЙёТИЁуЪ│уЂ░Т░┤
-
№╝ѕ4№╝Ѕ тЈќућеТ░еТ░┤Уё▒жЎцуЃЪТ░ћСИГSO2тЙЌтѕ░уџётЅ»С║ДтЊЂ[тЈфтљФ(NH4)2SO4тњїNH4HSO4] 3.875g№╝їСИјУХ│жЄЈNaOHТиитљѕтљјтіауЃГтЁЁтѕєтЈЇт║ћ№╝їтЁ▒ТћХжЏєтѕ░Т░еТ░ћ1.232L№╝ѕти▓ТіўтљѕСИ║ТаЄтЄєуіХтєх№╝Ѕ№╝їтѕЎУ»ЦтЅ»С║ДтЊЂСИГ(NH4)2SO4тњїNH4HSO4уџёуЅЕУ┤еуџёжЄЈС╣ІТ»ћn[(NH4)2SO4]РѕХn(NH4HSO4)№╝Ю№╝ѕтєЎтЄ║У«Ау«Ќу╗ЊТъютЇ│тЈ»№╝Ѕсђѓ
| жђЅжА╣ | т«ъжфїТЊЇСйю | уј░У▒А | у╗ЊУ«║ |
| A | т░єFe(NO3)2ТаитЊЂТ║ХС║јуеђуАФжЁИ№╝їТ╗┤тЁЦKSCNТ║ХТХ▓ | Т║ХТХ▓тЈўу║б | уеђуАФжЁИУЃйТ░ДтїќFe2№╝І |
| B | CuСИјТхЊуАФжЁИтЈЇт║ћ№╝їт«ъжфїу╗ЊТЮЪтљј№╝їт░єТ░┤тіатЁЦуЃДуЊХСИГ | Т║ХТХ▓тЈўУЊЮ | У»ЂТўјтЈЇт║ћућЪТѕљС║єCu2№╝І |
| C | тљЉТЪљТ║ХТХ▓СИГТ╗┤тіауеђуАФжЁИ | С║ДућЪТюЅтѕ║Т┐ђТђДТ░ћтЉ│уџёТ░ћСйЊ | тјЪТ║ХТХ▓СИГтЈ»УЃйтљФТюЅSO32- |
| D | тљЉуЏЏТюЅТЪљТ║ХТХ▓уџёУ»Ћу«АСИГТ╗┤тіаNaOHТ║ХТХ▓№╝їт░єТ╣┐ТХдуџёу║бУЅ▓уЪ│УЋіУ»Ћу║Иуй«С║јУ»Ћу«АтЈБ | У»Ћу║ИСИЇтЈўУЊЮ | тјЪТ║ХТХ▓СИГТЌаNH4+ |
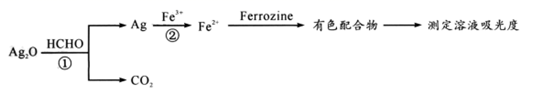
ти▓уЪЦ№╝џтљИтЁЅт║дСИјТ║ХТХ▓СИГТюЅУЅ▓уЅЕУ┤еуџёТхЊт║дТѕљТГБТ»ћсђѓСИІтѕЌУ»┤Т│ЋТГБуА«уџёТў»№╝ѕ №╝Ѕ
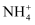 сђЂK+сђЂBa2+сђЂFe3+сђЂI-сђЂ
сђЂK+сђЂBa2+сђЂFe3+сђЂI-сђЂ  сђЂ
сђЂ  СИГуџётЄауДЇ№╝їуј░тЈќl00rnLТ║ХТХ▓тіатЁЦт░ЉжЄЈТ║┤Т░┤№╝їТ║ХТХ▓тЉѕТЌаУЅ▓сђѓу╗Ду╗ГТ╗┤тіаУХ│жЄЈHNO3тњїBa(NO3)2ТиитљѕТ║ХТХ▓№╝їС║ДућЪТ▓ЅТиђ№╝їТ▓ЅТиђу╗ЈТ┤ЌТХцсђЂжФўТИЕт╣▓уЄЦтљјУ┤ежЄЈСИ║4.66gсђѓТ╗цТХ▓тіаУХ│жЄЈNaOHТ║ХТХ▓сђЂтіауЃГ№╝їућЪТѕљТ░ћСйЊтюеТаЄтЄєуіХтєхСИІСйЊуД»СИ║1120rnLсђѓ(ти▓уЪЦУ┐ўтјЪТђД№╝џ
СИГуџётЄауДЇ№╝їуј░тЈќl00rnLТ║ХТХ▓тіатЁЦт░ЉжЄЈТ║┤Т░┤№╝їТ║ХТХ▓тЉѕТЌаУЅ▓сђѓу╗Ду╗ГТ╗┤тіаУХ│жЄЈHNO3тњїBa(NO3)2ТиитљѕТ║ХТХ▓№╝їС║ДућЪТ▓ЅТиђ№╝їТ▓ЅТиђу╗ЈТ┤ЌТХцсђЂжФўТИЕт╣▓уЄЦтљјУ┤ежЄЈСИ║4.66gсђѓТ╗цТХ▓тіаУХ│жЄЈNaOHТ║ХТХ▓сђЂтіауЃГ№╝їућЪТѕљТ░ћСйЊтюеТаЄтЄєуіХтєхСИІСйЊуД»СИ║1120rnLсђѓ(ти▓уЪЦУ┐ўтјЪТђД№╝џ  №╝ъI-)Та╣ТЇ«СИіУ┐░т«ъжфї№╝їС╗ЦСИІТјеТхІТГБуА«уџёТў»№╝ѕ №╝Ѕ
№╝ъI-)Та╣ТЇ«СИіУ┐░т«ъжфї№╝їС╗ЦСИІТјеТхІТГБуА«уџёТў»№╝ѕ №╝Ѕ
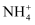 сђЂ
сђЂ  B . тјЪТ║ХТХ▓СИђт«џСИЇтљФBa2+сђЂFe3+сђЂI-
C . тјЪТ║ХТХ▓тЈ»УЃйтГўтюеK+сђЂ
B . тјЪТ║ХТХ▓СИђт«џСИЇтљФBa2+сђЂFe3+сђЂI-
C . тјЪТ║ХТХ▓тЈ»УЃйтГўтюеK+сђЂ  D . тЈдтЈќУ»ЋТХ▓Т╗┤тіаУХ│жЄЈуЏљжЁИсђЂBaCl2Т║ХТХ▓№╝їтЇ│тЈ»уА«т«џТ║ХТХ▓уд╗тГљу╗ёТѕљ
D . тЈдтЈќУ»ЋТХ▓Т╗┤тіаУХ│жЄЈуЏљжЁИсђЂBaCl2Т║ХТХ▓№╝їтЇ│тЈ»уА«т«џТ║ХТХ▓уд╗тГљу╗ёТѕљ
| жђЅжА╣ | т«ъжфїТЊЇСйю | т«ъжфїуЏ«уџё |
| A | тюеУІ»тњїУІ»жЁџуџёТиитљѕТХ▓СИГтіатЁЦУХ│жЄЈуџёТхЊТ║┤Т░┤№╝їТї»УЇАсђЂУ┐ЄТ╗ц | тѕєуд╗тЄ║УІ»жЁџ |
| B | тљЉтЇцС╗БуЃЃТ░┤УДБтљјуџёТ║ХТХ▓СИГтіатЁЦ | тѕцТќГтЇцу┤атјЪтГљуДЇу▒╗ |
| C | Тиђу▓ЅСИј20%уџёуАФжЁИТиитљѕТ║ХТХ▓тюеТ▓ИТ░┤Тх┤СИГтЁЁтѕєтіауЃГтљјТ╗┤тіаубўТ░┤ | жфїУ»ЂТиђу▓ЅТў»тљдТ░┤УДБт«їтЁе |
| D | тљЉ | У»ЂТўј |

-
№╝ѕ1№╝Ѕ ТхЊуАФжЁИСИјТюеуѓГу▓ЅтюетіауЃГТЮАС╗ХСИІтЈЇт║ћуџётїќтГдТќ╣уеІт╝ЈСИ║сђѓ
-
№╝ѕ2№╝Ѕ тдѓТъюУБЁуй«СИГРЉаРЉАРЉбСИЅжЃетѕєС╗фтЎеуџёУ┐ъТјЦжА║т║ЈТћ╣СИ║РЉАРЉаРЉб№╝їтѕЎтЈ»С╗ЦТБђтЄ║уџёуЅЕУ┤еТў»№╝їСИЇУЃйТБђтЄ║уџёуЅЕУ┤еТў»сђѓ
-
№╝ѕ3№╝Ѕ тдѓТъют░єС╗фтЎеуџёУ┐ъТјЦжА║т║ЈтЈўСИ║РЉаРЉбРЉА№╝їтѕЎСИЇУЃйТБђтЄ║уџёуЅЕУ┤еТў»сђѓ
-
№╝ѕ4№╝Ѕ тдѓТъют░єРЉАСИГжЁИТђД
 Т║ХТХ▓ТЇбТѕљТ║┤Т░┤№╝їТў»тљдтй▒тЊЇТБђжфїућЪТѕљуџёТ░ћСйЊ№╝Ъ№╝Џ
Т║ХТХ▓ТЇбТѕљТ║┤Т░┤№╝їТў»тљдтй▒тЊЇТБђжфїућЪТѕљуџёТ░ћСйЊ№╝Ъ№╝Џ  СИјТ║┤Т░┤тЈЇт║ћуџёуд╗тГљТќ╣уеІт╝ЈСИ║сђѓ
СИјТ║┤Т░┤тЈЇт║ћуџёуд╗тГљТќ╣уеІт╝ЈСИ║сђѓ
жђЅжА╣ | т«ъжфїуЏ«уџё | т«ъжфїТЊЇСйю |
A | ТБђжфїТ║ХТХ▓СИГуџё | тЈќТаи№╝їтљЉтЁХСИГтіатЁЦ |
B | жЎцтј╗жЎёуЮђтюеУ»Ћу«АтєЁтБЂуџёуАФ | тіаТ░┤тє▓Т┤Ќ |
C | жЅ┤тѕФ | тЈќТаи№╝їтѕєтѕФСИјуєЪуЪ│уЂ░ТиитљѕуаћуБе№╝їжЌ╗Т░ћтЉ│ |
D | жЅ┤тѕФ | тЈќТаи№╝їтѕєтѕФтљЉтЁХСИГТ╗┤тіа |
| УБЁуй« | т«ъжфї | У»ЋтЅѓa | уј░У▒АСИју╗ЊТъю |
| | I | 10hтљј№╝їТХ▓СйЊтЈўСИ║ТхЁУЊЮУЅ▓№╝їт░єжЊюуЅЄтЈќтЄ║сђЂт╣▓уЄЦ№╝їжЊюУАежЮбжЎёуЮђУЊЮУЅ▓тЏ║СйЊ№╝їТѕљтѕєТў»Cu(OH)2 | |
| II | 8mL5mol/LТ░еТ░┤ | уФІтЇ│С║ДућЪтцДжЄЈТ░ћТ│А№╝їТ║ХТХ▓тЈўСИ║Ти▒УЊЮУЅ▓№╝їт░єжЊюуЅЄтЈќтЄ║сђЂт╣▓уЄЦ№╝їжЊюУАежЮбжЎёуЮђУЊЮУЅ▓тЏ║СйЊ№╝їТѕљтѕєТў»Cu(OH)2 | |
| III | 8mL5mol/LТ░еТ░┤тњї1gNH4ClтЏ║СйЊ | уФІтЇ│С║ДућЪтцДжЄЈТ░ћТ│А№╝їТ║ХТХ▓тЈўСИ║Ти▒УЊЮУЅ▓№╝їт░єжЊюуЅЄтЈќтЄ║сђЂт╣▓уЄЦ№╝їжЊюуЅЄСЙЮуёХС┐ЮТїЂтЁЅС║« |
СИІтѕЌУ»┤Т│ЋжћЎУ»»уџёТў»№╝ѕ №╝Ѕ
 №╝Џ
№╝Џ сђѓТЪљтїќтГдтЁ┤УХБт░Ју╗ёСИ║С║єТхІт«џСИЂуЃиУБѓУДБТ░ћСИГ
сђѓТЪљтїќтГдтЁ┤УХБт░Ју╗ёСИ║С║єТхІт«џСИЂуЃиУБѓУДБТ░ћСИГ тњї
тњї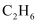 уџёТ»ћСЙІтЁ│у│╗№╝їУ«ЙУ«Ат«ъжфїтдѓСИІтЏЙТЅђуц║№╝џ
уџёТ»ћСЙІтЁ│у│╗№╝їУ«ЙУ«Ат«ъжфїтдѓСИІтЏЙТЅђуц║№╝џ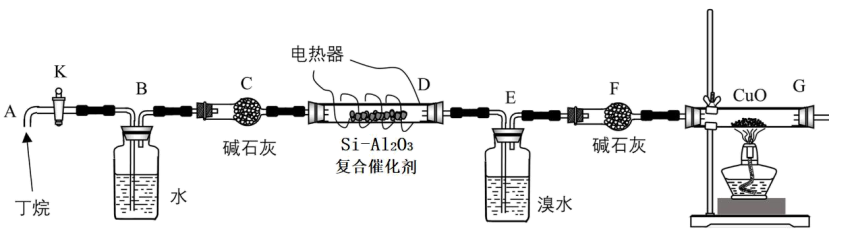
тдѓтЏЙУ┐ъТјЦтЦйУБЁуй«тљј№╝їжюђУ┐ЏУАїуџёТЊЇСйюТюЅ№╝џРЉау╗ЎDсђЂGУБЁуй«тіауЃГ№╝ЏРЉАТБђТЪЦТЋ┤тЦЌУБЁуй«уџёТ░ћт»єТђД№╝ЏРЉбућеТЃ░ТђДТ░ћСйЊТјњтЄ║УБЁуй«СИГуџёуЕ║Т░ћуГЅРђдРђд
Т│е№╝џCuOУЃйт░єуЃЃТ░ДтїќТѕљ тњї
тњї №╝Џ
№╝Џ Тў»уЃиуЃЃУБѓУДБуџётѓгтїќтЅѓ№╝ЏGтљјжЮбУБЁуй«ти▓уюЂуЋЦсђѓ
Тў»уЃиуЃЃУБѓУДБуџётѓгтїќтЅѓ№╝ЏGтљјжЮбУБЁуй«ти▓уюЂуЋЦсђѓ
-
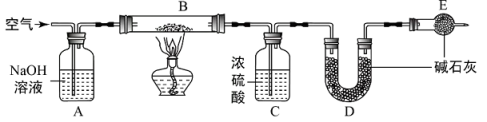
№╝ѕ1№╝Ѕ У┐ЎСИЅТГЦТЊЇСйюуџётЁѕтљјжА║т║ЈТў»(тАФт║ЈтЈи)
-
№╝ѕ2№╝Ѕ УБЁуй«BуџёСйюућеТў»сђѓ
-
№╝ѕ3№╝Ѕ УБЁуй«EСИГуџёуј░У▒АТў»сђѓ
-
№╝ѕ4№╝Ѕ тЂЄт«џСИЂуЃит«їтЁеУБѓУДБ№╝їСИћТхЂу╗ЈтљёУБЁуй«СИГуџёТ░ћСйЊУЃйт«їтЁетЈЇт║ћсђѓтйЊУБЁуй«EтњїFуџёТђ╗У┤ежЄЈТ»ћтЈЇт║ћтЅЇтбътіаС║є0.7g№╝їGУБЁуй«СИГтЏ║СйЊУ┤ежЄЈТ»ћтЈЇт║ћтЅЇтЄЈт░ЉС║є1.76g№╝їтѕЎтюеСИЂуЃиуџёУБѓУДБС║ДуЅЕСИГ
 тњї
тњї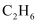 уџёуЅЕУ┤еуџёжЄЈС╣ІТ»ћ
уџёуЅЕУ┤еуџёжЄЈС╣ІТ»ћ сђѓ
сђѓ
|
|
|
|
A№╝јТБђжфїУЇЅТюеуЂ░СИГжњЙтЁЃу┤ауџётГўтюе | B№╝јућеС║јтѕєуд╗I2тњї | C№╝јТ»ћУЙЃSсђЂCсђЂSiуџёжЮъжЄЉт▒ъТђД | D№╝јт«ъжфїт«цСИГС┐ЮтГўТХ▓Т║┤ |

тїќтљѕуЅЕXтюеуЕ║Т░ћСИГтіауЃГтѕ░ №╝ї СИЇтЈЉућЪтЈЇт║ћсђѓ
№╝ї СИЇтЈЉућЪтЈЇт║ћсђѓ
У»итЏъуГћ№╝џ
-
№╝ѕ1№╝Ѕ у╗ёТѕљXуџёСИЅуДЇтЁЃу┤аСИ║№╝ЏXуџётїќтГдт╝ЈСИ║сђѓ
-
№╝ѕ2№╝Ѕ Т║ХТХ▓CуџёТ║ХУ┤еу╗ёТѕљСИ║№╝ѕућетїќтГдт╝ЈУАеуц║№╝Ѕсђѓ
-
№╝ѕ3№╝Ѕ РЉатєЎтЄ║ућ▒Xтѕ░AуџётїќтГдТќ╣уеІт╝Јсђѓ
РЉАXжџЙТ║ХС║јТ░┤№╝їСйєтЈ»Т║ХС║јТ░еТ░┤СИГ№╝їтєЎтЄ║У»ЦтЈЇт║ћуџёуд╗тГљТќ╣уеІт╝Јсђѓ
-
№╝ѕ4№╝Ѕ У«ЙУ«Ат«ъжфї№╝їТБђжфїт░ЙТ░ћСИГуЏИт»╣Т┤╗Т│╝уџё2уДЇТ░ћСйЊсђѓ
жђЅжА╣ | СИЇу║»уЅЕУ┤е | ТБђжфї | жЎцТЮѓ |
A | NO2СИГТииТюЅт░ЉжЄЈNO | УДѓт»ЪжбюУЅ▓ | СЙЮТгАжђџУ┐ЄТ░┤сђЂТхЊуАФжЁИ |
B | ућ▓уЃиСИГТииТюЅт░ЉжЄЈС╣ЎуЃ» | Т║┤Т░┤ | СЙЮТгАжђџУ┐ЄжЁИТђДKMnO4Т║ХТХ▓сђЂТхЊуАФжЁИ |
C | COСИГТииТюЅт░ЉжЄЈCO2 | ТЙёТИЁуЪ│уЂ░Т░┤ | СЙЮТгАжђџУ┐ЄТ░бТ░ДтїќжњаТ║ХТХ▓сђЂТхЊуАФжЁИ |
D | Na2CO3Т║ХТХ▓СИГТииТюЅт░ЉжЄЈNaHCO3 | Ca(OH)2Т║ХТХ▓ | тіатЁЦжђѓжЄЈуџёNaOHТ║ХТХ▓ |
-
№╝ѕ1№╝Ѕ I.ућ▓Тќ╣ТАѕ
т«ъжфїтјЪуљє№╝џCuSO4+BaCl2=BaSO4РєЊ+CuCl2
т«ъжфїТГЦжфц№╝џ

тѕцТќГSO
 Т▓ЅТиђт«їтЁеуџёТЊЇСйюТў»сђѓ
Т▓ЅТиђт«їтЁеуџёТЊЇСйюТў»сђѓ -
№╝ѕ2№╝Ѕ ТГЦжфцРЉауџёТЊЇСйютљЇуД░Тў»№╝їТГЦжфцРЉАтѕцТќГТ▓ЅТиђТў»тљдТ┤ЌтЄђТЅђжђЅућеуџёУ»ЋтЅѓТў»№╝їТГЦжфцРЉбуЂ╝уЃДТЌХуЏЏУБЁТаитЊЂуџёС╗фтЎетљЇуД░Тў»№╝їТа╣ТЇ«тЏ║СйЊwgТ▒ѓтЙЌc(CuSO4)=mol┬иL-1сђѓ
-
№╝ѕ3№╝Ѕ II.С╣ЎТќ╣ТАѕ
т«ъжфїтјЪуљє№╝џZn+CuSO4=ZnSO4+Cu№╝їZn+H2SO4=ZnSO4+H2РєЉ
т«ъжфїТГЦжфц№╝џ
РЉаТїЅтдѓтЏЙт«ЅУБЁУБЁуй«(тц╣ТїЂС╗фтЎеуЋЦтј╗)№╝Џ
РЉАРђдРђд
РЉбтюеС╗фтЎеAсђЂBсђЂCсђЂDсђЂEСИГтіатЁЦтЏЙуц║уџёУ»ЋтЅѓ№╝Џ
РЉБУ░ЃТЋ┤DсђЂEСИГСИцТХ▓жЮбуЏИт╣│№╝їСй┐DСИГТХ▓жЮбС┐ЮТїЂтюе0ТѕќуЋЦСйјС║ј0тѕ╗т║дСйЇуй«№╝їУ»╗ТЋ░т╣ХУ«░тйЋ№╝Џ
РЉцт░єCuSO4Т║ХТХ▓Т╗┤тЁЦAСИГт╣ХТљЁТІї№╝їтЈЇт║ћт«їТѕљтљј№╝їтєЇТ╗┤тіауеђуАФжЁИУЄ│СйЊу│╗СИЇтєЇТюЅТ░ћСйЊС║ДућЪ№╝Џ
РЉЦт░єСйЊу│╗ТЂбтцЇтѕ░т«цТИЕ№╝їуД╗тіеEу«А№╝їС┐ЮТїЂDсђЂEСИГСИцТХ▓жЮбуЏИт╣│№╝їУ»╗ТЋ░т╣ХУ«░тйЋ№╝Џ
РЉдтцёуљєТЋ░ТЇ«сђѓ
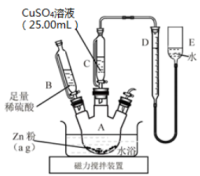
ТГЦжфцРЉАСИ║сђѓТГЦжфцРЉЦжюђС┐ЮУ»ЂСйЊу│╗ТЂбтцЇтѕ░т«цТИЕуџётјЪтЏаТў»(тАФт║ЈтЈи)сђѓ
a.тЈЇт║ћуЃГтЈЌТИЕт║дтй▒тЊЇ b.Т░ћСйЊт»єт║дтЈЌТИЕт║дтй▒тЊЇ c.тЈЇт║ћжђЪујЄтЈЌТИЕт║дтй▒тЊЇ
-
№╝ѕ4№╝Ѕ Znу▓ЅУ┤ежЄЈСИ║ag№╝їУІЦТхІтЙЌH2СйЊуД»СИ║bmL№╝їти▓уЪЦт«ъжфїТЮАС╗ХСИІ¤Ђ(H2)=dgРђбL-1 №╝ї тѕЎc(CuSO4)=mol┬иL-1(тѕЌтЄ║У«Ау«ЌУАеУЙЙт╝Ј)сђѓУІЦТГЦжфцРЉЦEу«АТХ▓жЮбжФўС║јDу«А№╝їТюфУ░ЃТХ▓жЮбтЇ│У»╗ТЋ░№╝їтѕЎТхІтЙЌc(CuSO4)(тАФРђютЂЈжФўРђЮРђютЂЈСйјРђЮТѕќРђюТЌатй▒тЊЇРђЮ)сђѓ
 тњї
тњї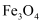 сђѓ
сђѓ
-
№╝ѕ1№╝Ѕ С╗фтЎеaуџётљЇуД░сђѓ
-
№╝ѕ2№╝Ѕ УБЁуй«AСИГтЈЉућЪтЈЇт║ћуџётїќтГдТќ╣уеІт╝ЈСИ║сђѓ
-
№╝ѕ3№╝Ѕ УБЁуй«BуџёСйюућеТў»тљИТћХ
 №╝ї тЈЉућЪтЈЇт║ћуџёуд╗тГљТќ╣уеІт╝ЈСИ║№╝ЏУ»иУ«ЙУ«Ат«ъжфїУ»ЂТўјтЈЇт║ћт«їТѕљтљјУБЁуй«BуџёТ║ХТХ▓СИГТЌбТюЅ
№╝ї тЈЉућЪтЈЇт║ћуџёуд╗тГљТќ╣уеІт╝ЈСИ║№╝ЏУ»иУ«ЙУ«Ат«ъжфїУ»ЂТўјтЈЇт║ћт«їТѕљтљјУБЁуй«BуџёТ║ХТХ▓СИГТЌбТюЅ тЈѕТюЅ
тЈѕТюЅ №╝џ(тЈ»жђЅућеуџёУ»ЋтЅѓ№╝џтЈїТ░ДТ░┤сђЂуАФТ░░тїќжњЙТ║ХТХ▓сђЂжЁИТђДжФўжћ░жЁИжњЙТ║ХТХ▓)сђѓ
№╝џ(тЈ»жђЅућеуџёУ»ЋтЅѓ№╝џтЈїТ░ДТ░┤сђЂуАФТ░░тїќжњЙТ║ХТХ▓сђЂжЁИТђДжФўжћ░жЁИжњЙТ║ХТХ▓)сђѓ
-
№╝ѕ4№╝Ѕ тљЉУБЁуй«BСИГтіажђѓжЄЈуџёNaOHТ║ХТХ▓№╝їу╗ЈУ┐ЄТ╗цсђЂТ┤ЌТХцсђЂуЂ╝уЃДтѕХтЙЌ
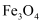 ТаитЊЂ№╝їСИ║ТхІт«џУ»Ц
ТаитЊЂ№╝їСИ║ТхІт«џУ»Ц (тљФТюЅFeO)ТаитЊЂуџёу║»т║д№╝їУ┐ЏУАїуџёт«ъжфїТГЦжфцтдѓСИІ№╝џ
(тљФТюЅFeO)ТаитЊЂуџёу║»т║д№╝їУ┐ЏУАїуџёт«ъжфїТГЦжфцтдѓСИІ№╝џТГЦжфц1№╝џуД░тЈќСИђт«џжЄЈТаитЊЂуй«С║јжћЦтйбуЊХСИГ№╝їтіатЁЦУХ│жЄЈуеђуАФжЁИ№╝їтіауЃГСй┐С╣Іт«їтЁеТ║ХУДБсђѓ
ТГЦжфц2№╝џтљЉжћЦтйбуЊХСИГТ╗┤тіа
 Т║ХТХ▓№╝їтЈЉућЪтЈЇт║ћ№╝џ
Т║ХТХ▓№╝їтЈЉућЪтЈЇт║ћ№╝џ №╝ї ТЂ░тЦйт«їтЁетЈЇт║ћТЌХ№╝їтЁ▒ТХѕУђЌ
№╝ї ТЂ░тЦйт«їтЁетЈЇт║ћТЌХ№╝їтЁ▒ТХѕУђЌ Т║ХТХ▓сђѓ
Т║ХТХ▓сђѓТГЦжфц3№╝џт░єТГЦжфц2тЙЌтѕ░Т║ХТХ▓жЁЇтѕХТѕљ1000mLТ║ХТХ▓№╝їтЈќУ»ЦТ║ХТХ▓1.00mL№╝їуеђжЄіУЄ│25.6L№╝їТхІтЙЌТ║ХТХ▓уџётљИтЁЅт║дСИ║0.7618.ти▓уЪЦ№╝џтљИтЁЅт║дСИјТ║ХТХ▓СИГжЊЂуд╗тГљтљФжЄЈ(c)уџёТаЄтЄєТЏ▓у║┐тдѓтЏЙсђѓ
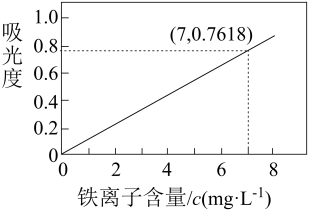
У«Ау«ЌТаитЊЂСИГ
 уџёуЅЕУ┤еуџёжЄЈ(тєЎтЄ║У«Ау«ЌУ┐ЄуеІ)сђѓ
уџёуЅЕУ┤еуџёжЄЈ(тєЎтЄ║У«Ау«ЌУ┐ЄуеІ)сђѓ
-
№╝ѕ1№╝Ѕ I.т«ъжфїт«цтЈ»ућетдѓтЏЙућ▓ТЅђуц║УБЁуй«ТјбуЕХуЪ│УюАТ▓╣уџётѕєУДБт«ъжфїсђѓ
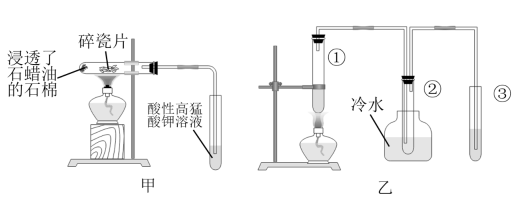
т«ъжфїт╝ђтДІтљј№╝їжЁИТђДжФўжћ░жЁИжњЙТ║ХТХ▓СИГУДѓт»Ътѕ░уџёуј░У▒АТў»№╝Џ
-
№╝ѕ2№╝Ѕ II.т«ъжфїУБЁуй«С╣ЪтЈ»С╗ЦТћ╣СИ║тдѓтЏЙС╣ЎТЅђуц║УБЁуй«№╝џтюеУ»Ћу«АРЉаСИГтіатЁЦуЪ│УюАТ▓╣тњїТ░ДтїќжЊЮ№╝їт░єУ»Ћу«АРЉАТћЙтюетєиТ░┤СИГ№╝їтюеУ»Ћу«АРЉбСИГтіатЁЦжЁИТђДжФўжћ░жЁИжњЙТ║ХТХ▓сђѓ
У»Цт«ъжфїСИГТ░ДтїќжЊЮуџёСйюућеТў»сђѓтіатЁЦУЇ»тЊЂтЅЇ№╝їт┐ЁжА╗У┐ЏУАїуџёТЊЇСйюТў»сђѓУБЁуй«СИГ№╝їтєиТ░┤уџёСйюућеТў»сђѓ
-
№╝ѕ3№╝Ѕ У»Ћу«АРЉАСИГуџёТХ▓СйЊ(тАФРђюУЃйРђЮТѕќРђюСИЇУЃйРђЮ)ућеС║јУљЃтЈќТ║┤Т░┤СИГуџёТ║┤№╝їУ»┤Тўјуљєућ▒№╝џсђѓ
-
№╝ѕ4№╝Ѕ III.ућетЏЙСИЎТЅђуц║УБЁуй«тЈ»тѕХтЈќС╣ЎжЁИС╣ЎжЁ»сђѓтюеУ»Ћу«АaСИГтіатЁЦ
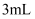 С╣ЎжєЄ№╝їуёХтљјУЙ╣Тї»УЇАУ»Ћу«АУЙ╣ТЁбТЁбтіатЁЦ
С╣ЎжєЄ№╝їуёХтљјУЙ╣Тї»УЇАУ»Ћу«АУЙ╣ТЁбТЁбтіатЁЦ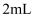 ТхЊуАФжЁИтњї
ТхЊуАФжЁИтњї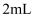 С╣ЎжЁИсђѓ
С╣ЎжЁИсђѓ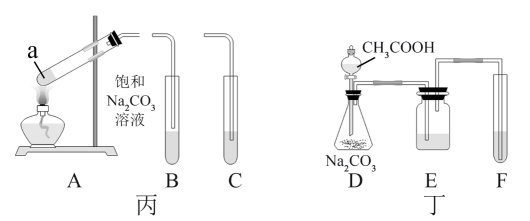
тЏЙСИЎСИГУБЁуй«Aуџёт»╝у«Ат║ћСИјУБЁуй«уџёт»╝у«АуЏИУ┐ъ(тАФРђюBРђЮТѕќРђюCРђЮ)№╝їУ»Ћу«АaСИГТхЊуАФжЁИуџёСйюућеТў»сђѓ
IV.ућетЏЙСИЂТЅђуц║уџёУБЁуй«тЈ»Т»ћУЙЃжєІжЁИсђЂуб│жЁИтњїуАЁжЁИуџёжЁИТђДт╝║т╝▒сђѓ
-
№╝ѕ5№╝Ѕ тЏЙСИЂСИГEСИГуЏЏУБЁуџёУ»ЋтЅѓТў»№╝їУ»итєЎтЄ║FСИГтЈЉућЪтЈЇт║ћуџёуд╗тГљТќ╣уеІт╝Јсђѓ
сђљУхёТќЎсђЉ
a.ТхЊуАФжЁИтИИућеС║јтљИТћХТ░┤УњИТ░ћ№╝Џ
b. уб▒уЪ│уЂ░Тў»тЏ║СйЊТ░бТ░ДтїќжњатњїТ░ДтїќжњЎуџёТиитљѕуЅЕсђѓ
-
№╝ѕ1№╝Ѕ УБЁуй«EуџётљЇуД░Тў»сђѓ
-
№╝ѕ2№╝Ѕ т«їТѕљУ»Цт«ъжфїУдЂУ┐ЏУАїС╗ЦСИІТЊЇСйю№╝їТГБуА«уџёТЊЇСйюжА║т║ЈСИ║сђѓ
РЉауѓ╣уЄЃжЁњу▓ЙуЂ» РЉАуєёуЂГжЁњу▓ЙуЂ» РЉбУ┐ъТјЦСИіDсђЂEУБЁуй« РЉБжђџтЁЦСИђТ«хТЌХжЌ┤уџёуЕ║Т░ћ РЉцтєЇжђџтЁЦСИђТ«хТЌХжЌ┤уџёуЕ║Т░ћ
-
№╝ѕ3№╝Ѕ т«ъжфїСИГуД░тЈќУєеТЮЙтЅѓ6.0g№╝їт«ъжфїу╗ЊТЮЪтљјУБЁуй«(тАФУБЁуй«т»╣т║ћуџётГЌТ»ЇугдтЈи)тбъжЄЇ1.32g№╝їтЇ│СИ║ТаитЊЂС║ДућЪС║їТ░Дтїќуб│уџёУ┤ежЄЈсђѓт«ъжфїУ┐ЄуеІСИГУБЁуй«BтЈЉућЪтЈЇт║ћуџётїќтГдТќ╣уеІт╝ЈСИ║№╝їУ»ЦУєеТЮЙтЅѓуџёУ»ЦжА╣ТїЄТаЄСИ║mL/g сђѓ
 Т║ХТХ▓
Т║ХТХ▓ Т║ХТХ▓СИГТ╗┤тЁЦжЁИТђД
Т║ХТХ▓СИГТ╗┤тЁЦжЁИТђД  Т║ХТХ▓
Т║ХТХ▓
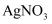 Т║ХТХ▓
Т║ХТХ▓ СИј
СИј тЏ║СйЊ
тЏ║СйЊ Т║ХТХ▓СИј
Т║ХТХ▓СИј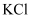 Т║ХТХ▓
Т║ХТХ▓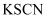 Т║ХТХ▓
Т║ХТХ▓