物质的分离与提纯 知识点题库
CrO42﹣  Cr2O72﹣
Cr2O72﹣  Cr3+
Cr3+  Cr(OH)3↓
Cr(OH)3↓
已知转化过程中的反应为:2CrO42﹣(aq)+2H+(aq)═Cr2O72﹣(aq)+H2O(1).转化后所得溶液中铬元素含量为28.6g/L,CrO42﹣有10/11转化为Cr2O72﹣ . 下列说法不正确的是( )

-
(1) 沉淀1中含有的金属单质是.
-
(2) 氧化时加入H2O2溶液发生反应的离子方程式为.
-
(3) 下列物质中,可以作为试剂X的是 (填字母).A . BaCl2 B . BaCO3 C . NaOH D . Ba(OH)2
-
(4) 检验沉淀2洗涤是否完全的方法是.
-
(5) 制备氯化铁晶体过程中需保持盐酸过量,其目的是.
-
(6) 由过滤2得到的滤液制备BaCl2的实验操作依次为、冷却结晶、、洗涤、干燥.
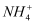 、Fe3+、
、Fe3+、  、Cl﹣ . 为除去杂质离子,部分操作流程如图:
、Cl﹣ . 为除去杂质离子,部分操作流程如图: 
请回答问题:
-
(1) 用稀硫酸浸泡某矿石后的溶液中,硫酸的密度为4.9g•L﹣1 , 则该溶液中的pH约为.
-
(2)
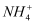 在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c(
在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在.现有一份(NH4)2SO4溶液,一份NH4Cl溶液,(NH4)2SO4溶液中c( 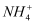 )恰好是NH4Cl溶液中c(
)恰好是NH4Cl溶液中c( 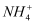 )的2倍,则c[(NH4)2SO4]c(NH4Cl)(填:<、=或>).
)的2倍,则c[(NH4)2SO4]c(NH4Cl)(填:<、=或>).
-
(3) 随着向废液中投入生石灰(忽略溶液温度的变化),溶液中
 (填“增大”、“减小”或“不变”).
(填“增大”、“减小”或“不变”).
-
(4) 投入生石灰调节pH到2~3时,大量沉淀主要成分为CaSO4•2H2O[含有少量Fe(OH)3],提纯CaSO4•2H2O的主要操作步骤:向沉淀中加入过量,充分反应后,过滤、洗涤、.
-
(5) 25℃,H3AsO4电离常数为K1=5.6×10﹣3 , K2=1.7×10﹣7 , K3=4.0×10﹣12 . 当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2 .
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是.
②Na3AsO4第一步水解的平衡常数数值为:
③已知:
 +2I﹣+2H+═
+2I﹣+2H+═  +I2+H2O,SO2+I2+2H2O═
+I2+H2O,SO2+I2+2H2O═ 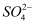 +2I﹣+4H+ . 上述两个反应中还原性最强的微粒是.
+2I﹣+4H+ . 上述两个反应中还原性最强的微粒是.

请回答下列问题:
-
(1) 上述实验流程中加入过量的Na2CO3的目的是.
-
(2) 按此实验方案得到的溶液3中肯定含有(填化学式)杂质;为了解决这个问题,可以向溶液3中加入适量的,之后若要获得固体NaNO3需进行的实验操作是(填操作名称).
-
(3) 下列是某学生设计NaCl、Na2SO4、NaNO3混合物中Cl﹣、SO42﹣的检验步骤请根据内容填空:
①首先检验离子,应先加入过量的,检验是否加入过量的方法
②将所得混合物(填操作名称),然后在溶液中加入试剂检验另一离子.
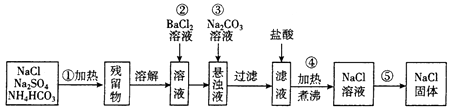
请根据操作流程回答下列问题:
-
(1) 操作①在加热时应选择盛装混合物(填仪器名称)。
-
(2) 进行操作②后,判断SO42-已沉淀完全的方法是。
-
(3) 操作③的离子方程式为。
-
(4) 操作④的目的是。
-
(5) 实验室进行操作⑤的具体步骤是。
-
(6) 某同学欲用制得的氯化钠固体配制100mL0.2mol·L-1的氯化钠溶液。
①配制NaCl溶液时需用到的主要仪器有托盘天平、药匙、烧杯、玻璃棒、量筒、。
②下列操作会使所配氯化钠溶液浓度偏小的是(请填序号)。
A.加水定容时俯视刻度线
B.容量瓶内壁附有水珠而未干燥处理
C.在溶解过程中有少量液体溅出烧杯外
D.颠倒摇匀后发现凹液面低于刻度线又加水补上

-
(1) 溶解海带灰时要加热煮沸2~3min的目的是,操作a的名称是 。
-
(2) 向酸化的溶液I中加入H2O2的目的是。
-
(3) 已知I2与40%的NaOH溶液反应生成的氧化产物和还原产物的物质的量之比为1:5,则发生反应的化学方程式是。
-
(4) 最后过滤得到的I2需要进行洗涤和干燥,下列洗涤剂中最应该选用的是。
a.热水
b.乙醇
c.冷水
d.二硫化碳
-
(5) 用Na2S2O3的标准溶液测定产品的纯度,发生反应:I2+2Na2S2O3=Na2S4O6+2NaI。取5.0g产品,配制成100ml溶液。取10.00ml溶液,以淀粉溶液为指示剂,用浓度为0.050mol·L-1Na2S2O3的标准溶液进行滴定,相关数据记录如下表所示。
编号
1
2
3
溶液的体积/mL
10.00
10.00
10.00
消耗Na2S2O3标准溶液的体积/mL
19.95
17.10
20.05
滴定时,达到滴定终点的现象是,碘单质在产品中的质量分数是% 。


-
(1) 试剂X应选择(选填“氢氧化钠溶液”、“盐酸”),反应①过滤后所得沉淀为 ;反应①的离子方程式;
-
(2) 反应②中Y是(写化学式);
-
(3) 写出由Al(OH)3加热为Al2O3的反应方程式
| 选项 | 物质 | 选用试剂 | 操作方法 |
| A | Fe2O3(Fe) | 盐酸 | 浸泡、过滤、洗涤、烘干 |
| B | CO(CO2) | KOH溶液、浓硫酸 | 洗气、干燥 |
| C | CaO(CaCO3) | 水 | 过滤、烘干 |
| D | NaCl(Na2CO3) | Ca(NO3)2溶液 | 溶解、过滤、蒸发、结晶 |
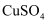 溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
溶液和过量NaOH溶液混合,然后加入几滴乙醛,加热煮沸观察红色沉淀
国家卫健委公布的《新型冠状病毒肺炎诊疗方案(试行》中提到:在相对封闭环境中,长时间暴露于高浓度气溶胶情况下,新冠病毒存在经气溶胶传播的可能。佩戴医用外科口罩可起到防护作用,含有病毒的飞沫会被口罩中间层熔喷无纺布(主要材质是聚丙烯)吸附。消毒也是控制病毒传播的有效措施,《新型冠状病毒肺炎流行期间预防性消毒指引》
-
(1) 建议:表面消毒可选择含氯消毒剂、%酒精,食饮具需要煮沸消毒15分钟以上。
-
(2) 气溶胶中粒子的大小为.
a.< lnm b.> 100nm c.1nm~100nm
-
(3) 丙烯在催化剂条件下制备聚丙烯,化学反应方程式为
-
(4) 75%酒精的有效成分是乙醇,乙醇的一种同分异构体的结构简式为。
-
(5) 食饮具可通过煮沸消毒,病毒蛋白质在加热条件下发生了。
-
(6) 环氧乙烷是一种低温灭菌剂, 经典的生产方法是氯代乙醇法,包括两步反应:
i.CH2=CH2+Cl2+H2O →ClCH2CH2OH+HCl
ii.ClCH2CH2OH+ HCl+Ca(OH)2 →
 + CaCl2 +2H2O
+ CaCl2 +2H2O现代石油化工采用低温催化法: 2CH2=CH2+O2


与氯代乙醇法相比,低温催化法的优点有、. ( 答两点)
| 选项 | 实验操作、现象 | 结论或实验目的 |
| A | 将混有乙烯的甲烷通过盛有溴的四氯化碳溶液的洗气瓶 | 乙烯被溴的四氯化碳溶液吸收,得到较纯净的甲烷 |
| B | 乙醇蒸气和乙烯都可以使酸性高锰酸钾溶液的紫红色褪去 | 乙醇和乙烯都被酸性高锰酸钾溶液氧化 |
| C | 将饱和NaOH溶液加到混有乙酸的乙酸乙酯中,并振荡、静置、分液 | 可得到纯净的乙酸乙酯 |
| D | 将苯和浓溴水加入烧瓶,再加入少量铁屑振荡 | 苯与溴发生取代反应生成溴 |
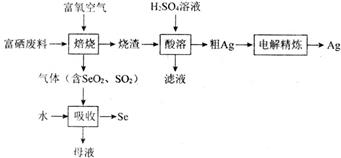

请回答下列问题:
-
(1) 步骤①中,为了加快酸溶速率,除了适当增加稀盐酸的浓度外,还可以采取的措施是(任写一条)。
-
(2) 步骤②得到的X是(填化学式)。
-
(3) 能够分离得到沉淀的方法是。
-
(4) 写出步骤④的化学方程式:。
物质 | 除杂试剂 | 分离方法 | |
A | NaCl溶液(I2) | CCl4 | 分液 |
B | CH3CH2OH(CH3COOH) | NaOH溶液 | 蒸馏 |
C | HCl(Cl2) | 饱和食盐水 | 洗气 |
D | CaCO3(CaSO4) | Na2CO3溶液 | 过滤 |



