指示剂 知识点题库
步骤 Ⅰ 称取样品1.500 g。
步骤 Ⅱ 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤 Ⅲ 移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
-
(1) 根据步骤 Ⅲ 填空:①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数(填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积(填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察(填序号)。
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由色变成色,且半分钟内不褪色。
-
(2) 滴定结果如下表所示:
滴定
次数
待测溶液的体积/mL
标准溶液的体积
滴定前刻度/mL
滴定后刻度/mL
1
25.00
1.02
21.03
2
25.00
2.00
21.99
3
25.00
0.20
20.20
若NaOH标准溶液的浓度为0.1010 mol·L-1则该样品中氮的质量分数为。
(2)有两份等体积的0.1mol/L的醋酸溶液,分别用蒸馏水和0.1mol/L的醋酸钠溶液稀释100倍,用0.1mol/L的醋酸钠溶液稀释后的溶液pH较 (填:“大”或“小”)原因:
花的种类 | 花汁在酒精中的颜色 | 花汁在稀酸中的颜色 | 花汁在稀碱中的颜色 |
玫瑰 | 粉色 | 粉色 | 绿色 |
万寿菊 | 黄色 | 黄色 | 黄色 |
大红花 | 粉色 | 橙色 | 绿色 |
请回答:
-
(1) 以上所举的花中不能作酸碱指示剂的是.
-
(2) 经查资料得知,柑橘的近似pH为3.0~4.0.将大红花汁的酒精溶液滴入柑橘汁中,呈现的颜色应为.

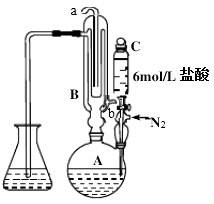
实验步骤如下:
I.SO2含量的测定
烧瓶A中加中药粉10g,加蒸馏水300 mL; 锥形瓶中加蒸馏水125mL和淀粉试液1mL作为吸收液; 打开冷凝水,通氮气,滴入盐酸10mL; 加热烧瓶A并保持微沸约3min后,用0.01000mol/L 碘标准溶液一边吸收一边滴定,至终点时消耗碘标准溶液V1mL;
Ⅱ.空白实验
只加300mL蒸馏水,重复上述操作,需碘标准溶液体积为V0mL.
-
(1) 仪器C的名称。仪器B的入水口为(填“a”或“b”)。
-
(2) 滴入盐酸前先通氮气一段时间作用是,测定过程中氮气的流速过快会导致测量结果。(填“偏大”“偏小”“不变”)
-
(3) ①滴定过程中使用的滴定管为。
A.酸式无色滴定管
B.酸式棕色滴定管
C.碱式无色滴定管
D.碱式棕色滴定管
②滴定时锥形瓶中反应的离子方程式为,滴定终点的现象是。
-
(4) 空白实验的目的是。
-
(5) 该中药中含SO2含量为mg/ kg。
Ⅰ.用已准确称量的 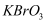 固体配制一定体积的
固体配制一定体积的  标准溶液;
标准溶液;
Ⅱ.取 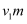 L上述溶液,加入过量
L上述溶液,加入过量 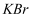 ,加
,加  酸化,溶液颜色呈棕黄色;
酸化,溶液颜色呈棕黄色;
Ⅲ.向Ⅱ所得溶液中加入 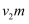 L废水
L废水
Ⅳ.向Ⅲ中加入过量KI;
Ⅴ.用 ![]() 标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗
标准溶液滴定Ⅳ中溶液至浅黄色时,滴加2滴淀粉溶液,继续滴定至终点,共消耗  溶液
溶液  L。
L。
已知: 
 和
和  溶液颜色均为无色
溶液颜色均为无色
-
(1) Ⅰ中配制溶液用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和。
-
(2) Ⅱ中发生反应的离子方程式是。
-
(3) Ⅲ中发生反应的化学方程式是。
-
(4) Ⅳ中加
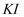 前,溶液颜色须为黄色,原因是。
前,溶液颜色须为黄色,原因是。
-
(5)
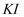 与
与 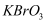 物质的量关系为
物质的量关系为  时,
时, 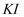 一定过量,理由是。
一定过量,理由是。
-
(6) V中滴定至终点的现象是。
-
(7) 废水中苯酚的含量为
 (苯酚摩尔质量:
(苯酚摩尔质量:  )
)
-
(8) 由于
 具有性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
具有性质,Ⅱ~Ⅳ中反应须在密闭容器中进行,否则会造成测定结果偏高。
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 将NaOH溶液逐滴滴加到AlCl3溶液中至过量 | 先产生白色胶状沉淀,后沉淀溶解 | Al(OH)3是两性氢氧化物 |
| B | NaHCO3溶液与NaAlO₂溶液混合 | 生成白色沉淀 | 结合H+的能力:CO32->AlO2- |
| C | 向盛有Na2SiO3 , 溶液的试管中滴加1滴酚酞,然后逐滴加入稀盐酸至过量 | 试管中红色逐渐褪去,出现白色凝胶 | 非金属性:Cl>Si |
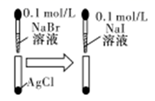
| D | | 白色固体先变为淡黄色,后变为黄色 | 溶度积常数:Ksp(AgCl)>Ksp(AgBr)>Ksp(AgI) |
已知:Ksp(HgS)=4.0×10-5。
|
(CN)2 |
沸点为-21.2℃,熔点为-34.4 ℃,化学性质与卤素单质相似,有剧毒,燃烧时火焰星紫红色,边缘略带蓝色 |
|
CS2 |
沸点为 46. 5℃,熔点为-111.9℃,能与酯互溶 |

回答下列问题:
-
(1) 仪器a的名称为。
-
(2) 已知Hg(SCN)2微溶于水,可由KSCN溶液与Hg(NO3)2溶液反应制得,若以Fe3+作指示剂,则当溶液变为色时,Hg2+沉淀完全。
-
(3) 待A中固体充分分解后,取下B装置,B瓶中有无色液体,并有类似氯仿的芳香甜味,与酯混合能够互溶,经查证,B中液体为CS2 , CS2可用于制造人造丝、杀虫剂,请举出一种其在实验室中的用途。
-
(4) 取下C装置,点燃C中气体,气体燃烧火焰呈紫红色,边缘略带蓝色,则E中反应的化学方程式为。
-
(5) 取下D装置,将燃着的镁条伸入瓶中,镁条会继续燃烧,取出燃烧产物,加入少量热水,产生的气体能使湿润的红色石蕊试纸变蓝,则证明Hg(SCN)2分解产物中含有。
-
(6) 取出A中剩余固体,加水溶解,固体不溶,加入王水固体溶解,则证明含有HgS。记溶解后的溶液为X。该固体(填“能”或“不能")溶于稀盐酸,原因是。
-
(7) 经上述推断,写出Hg(SCN)2分解的化学方程式。
-
(8) 若要测定Hg(SCN)2的分解率,可用NH4SCN滴定法测定溶液X中离子浓度。
已知:①3HgS+2HNO3+12HCl=3H2[HgCl4]+3S↓+2NO↑+4H2O;
②H2[HgCl4]+2SCN-=Hg(SCN)2↓+4Cl-+2H+;
③NH4SCN标准溶液中含有NH4Fe(SO4)2指示液。
若取上述溶液X,用浓度为c mol/L的NH4SCN标准溶液进行滴定,消耗V mL,忽略反应前后溶液体积变化,原Hg(SCN)2固体质量为m g,滴定终点的现象为,Hg(SCN)2的分解率为。
 )在工业上广泛应用于生产荧光粉。已知锶和镁位于同主族且锶比镁活泼,锶与氮气在加热条件下反应产生氮化锶,氮化锶遇水剧烈反应。某学习小组拟设计两套方案制备氮化锶并测定产品的纯度。
)在工业上广泛应用于生产荧光粉。已知锶和镁位于同主族且锶比镁活泼,锶与氮气在加热条件下反应产生氮化锶,氮化锶遇水剧烈反应。某学习小组拟设计两套方案制备氮化锶并测定产品的纯度。
-
(1) 方案I:根据下列装置制备氮化锶:

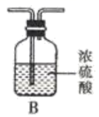


已知:实验室用饱和氯化铵溶液和亚硝酸钠溶液共热制备氮气。回答下列问题:
气流从左至右,选择装置并排序为 (用字母表示)。
-
(2) 写出实验室制备N2的化学方程式。
-
(3) 实验时先点燃处酒精灯(填“A”或“D”),一段时间后,点燃另一只酒精灯。
-
(4) 方案II:某氮气样品可能含有少量的CO、CO2、O2等气体杂质,某同学设计如下装置制备氮化锶(各装置盛装足量试剂)。已知:醋酸二氨合亚铜
 溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。
溶液能定量吸收CO,但易被O2氧化,失去吸收CO能力;连苯三酚碱性溶液能定量吸收O2。 
试管II、III、IV盛装的试剂分别是(填标号),装置Ⅵ的作用是。
a.连苯三酚碱性溶液 b.浓硫酸 c.醋酸二氨合亚铜溶液
测定产品纯度:称取9.0g方案II中所得产品,加入干燥的三颈瓶中,然后由恒压漏斗加入蒸馏水,通入水蒸气,将产生的氨全部蒸出,用
 的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)。从烧杯中量取
的盐酸标准溶液完全吸收(吸收液体体积变化忽略不计)。从烧杯中量取  的吸收液,用
的吸收液,用  标准溶液滴定过剩的HCl,到终点时消耗
标准溶液滴定过剩的HCl,到终点时消耗  溶液(图中夹持装置略)
溶液(图中夹持装置略)
-
(5) 用
 标准溶液滴定过剩的盐酸时所选指示剂为(填标号)。
标准溶液滴定过剩的盐酸时所选指示剂为(填标号)。 a.石蕊试液 b.甲基橙 c.酚酞试液
-
(6) 产品纯度为%(保留一位小数)。
-
(7) 下列实验操作可能使氮化锶(
 )测定结果偏低的是(填标号)。
)测定结果偏低的是(填标号)。 a.锥形瓶洗涤干净后未干燥,直接装入待测液
b.滴定时未用
 标准溶液润洗滴定管
标准溶液润洗滴定管c.滴定前滴定管尖嘴处有气泡,滴定结束后气泡消失
d.读数时,滴定前平视,滴定后俯视

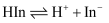 , 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )
, 其分子、离子为不同颜色。下表是酚酞在pH不同的溶液中的结构和变色规律。下列说法中错误的是( )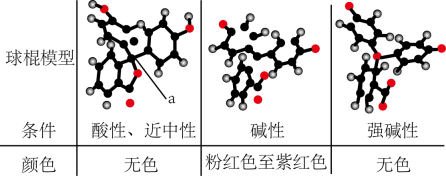
(图中环状结构为苯环)
 杂化转化为
杂化转化为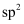 杂化
C . 当指示剂的
杂化
C . 当指示剂的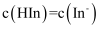 , 则
, 则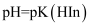 , 此时的pH为理论变色点
D . 温度改变,指示剂的变色范围可能发生改变
, 此时的pH为理论变色点
D . 温度改变,指示剂的变色范围可能发生改变
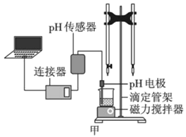
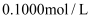 的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。
的盐酸滴定某未知浓度的NaOH溶液的示意图和某次滴定前、后盛放盐酸的滴定管中液面的位置。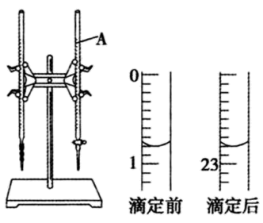
请回答下列问题;
-
(1) 仪器A的名称是。
-
(2) 依上图所示,此次滴定盐酸消耗的体积为mL。
-
(3) 某实验小组同学的三次实验的实验数据如下表所示。
实验编号
待测NaOH溶液的体积/mL
滴定前盐酸的体积读数/mL
滴定后盐酸的体积读数/mL
1
20.00
1.20
23.22
2
20.00
1.21
29.21
3
20.00
1.50
23.48
①此次滴定时选择的指示剂为。
②则待测NaOH溶液的平均浓度是
 (保留四位有效数字)。
(保留四位有效数字)。 -
(4) 对下列实验过程,因操作不正确而引起的误差,使待测NaOH溶液浓度偏高的有(填序号)。
①酸式滴定管水洗后在装液前未用标准盐酸润洗2~3次
②开始实验时酸式滴定管尖嘴部分有气泡,在滴定过程中气泡消失
③锥形瓶未干燥,有少量蒸馏水
④盛NaOH溶液的锥形瓶滴定前用NaOH溶液润洗2~3次
⑤放出碱液的滴定管开始有气泡,放出液体后气泡消失
⑥溶液颜色较浅时滴入酸液过快,停止滴定后反加一滴NaOH溶液,颜色无变化
⑦酸式滴定管滴定前仰视读数,滴定后俯视读数
⑧振荡锥形瓶时部分液体溅出
-
(5) 某实验小组为测定某固体样品中
 的含量,该物质的摩尔质量为
的含量,该物质的摩尔质量为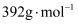 , 做了如下实验:
, 做了如下实验:测定原理:
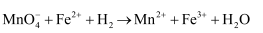 (方程式未配平)
(方程式未配平)测定步骤:步骤一,准确称量20.00g样品,配制成100mL溶液。
步骤二,取所配溶液25.00mL于锥形瓶中,加稀
 酸化,用
酸化,用 溶液滴定至终点,重复两次,平均消耗
溶液滴定至终点,重复两次,平均消耗 溶液16.00mL。
溶液16.00mL。①如何判断到达滴定终点?。
②产品中
 的质量分数为%(保留到小数点后一位)。
的质量分数为%(保留到小数点后一位)。