氯水、氯气的漂白作用 知识点题库
在实验室里可用如图所示装置来制取氯酸钠、次氯酸钠和探究氯水的性质. 如图中:
①为氯气发生装置;
②的试管里盛有15mL 30% NaOH溶液来制取氯酸钠,并置于热水浴中;
③的试管里盛有15mL 8% NaOH溶液来制取次氯酸钠,并置于冰水浴中;
④的试管里加有紫色石蕊试液;
⑤为尾气吸收装置.请填写下列空白:
(1)制取氯气时,在烧瓶里加入一定量的二氧化锰,通过 (填写仪器名称)向烧瓶中加入适量的浓盐酸.实验室制Cl2的化学方程式 ;
实验时为了除去氯气中的HCl气体,可在①与②之间安装盛有 (填写下列编号字母)的净化装置.
A.碱石灰 B.氢氧化钠溶液 C.饱和食盐水 D.浓硫酸
(2)如果将过量二氧化锰与20mL 12mol•L﹣1的浓盐酸混合加热,充分反应后生成的氯气
0.06mol.(填“大于”“小于”“等于”),若有17.4g的MnO2被还原,则被氧化的HCl质量为 .
(3)比较制取氯酸钠和次氯酸钠的条件,二者的差异是① ;② .
(4)实验中可观察到④的试管里溶液的颜色发生了如下变化,请填写如表中的空白.
实验现象 | 原因 |
溶液最初从紫色逐渐变为红色 | 氯气与水反应生成的H+使石蕊变色 |
随后溶液逐渐变为无色 |
|
然后溶液从无色逐渐变为 色 |
|

(1)知识储备:将氯气通入水中的化学方程式为 ;氯水中具有强氧化性的分子有 、 .
(2)探究“溶液的红色突然消失”的原因:
①猜想:
a.是氯水中的盐酸中和了NaOH,使酚酞由红色变成无色;
b.是 .
②设计实验:往已褪色的溶液中连续滴加NaOH溶液至过量,若现象为 ,则证明“猜想a”正确;若现象为 ,则“猜想b”正确.
-
(1) 制Cl2的反应中转移电子的数目?
-
(2) 生成Cl2的体积(标准状况下)?
-
(3) 制得漂白粉[CaCl2和Ca( ClO)2的混合物]的质量? (写出计算过程)
|
84消毒液 [有效成分] NaClO [规格] 1000mL [质量分数] 25% [密度] 1.192g·cm-3 |
回答下列问题:
-
(1) 工业上常用氯气与烧碱溶液反应制取84消毒液,写出反应的离子方程式。
-
(2) 84消毒液使用时需要稀释。某化学实验小组用上述84消毒液配制480mL0.2mol·L-1的稀溶液。
①量取84消毒液mL。
②洗涤时需要将仪器(填名称)洗涤2~3次。
③定容时加蒸馏水不慎超过了刻度线,此时应采取的处理方法是;该小组同学用量筒量取84消毒液时,仰视观察液面,所配溶液的浓度会(填“偏高”、“偏低”或“无影响")。
-
(3) 向84消毒液中加入少量稀硫酸可以增强漂白消毒效果,请解释其原因(用化学方程式回答)。
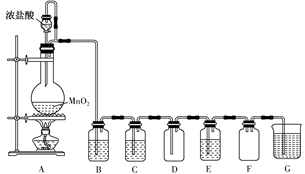
-
(1) 圆底烧瓶中发生反应的化学方程式为。
-
(2) 若要得到干燥纯净的气体,则B中应盛放的试剂是,作用是;C中应盛放的试剂是,作用是。
-
(3) E中若装有淀粉KI溶液,能观察到的实验现象是。
-
(4) Cl2的密度比空气,且(填“能”或“不能”)溶于水,难溶于饱和食盐水,因此可用法或排饱和食盐水法收集。
-
(5) G中的试剂可为。
 Fe(OH)3(胶体)+3H+
C . 钢铁发生吸氧腐蚀,负极反应为:Fe-2e-=Fe2+
D . 盛装强碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=
Fe(OH)3(胶体)+3H+
C . 钢铁发生吸氧腐蚀,负极反应为:Fe-2e-=Fe2+
D . 盛装强碱溶液的试剂瓶不能用玻璃塞:SiO2+2OH-=  +H2O
+H2O
-
(1) “84消毒液”的有效成分为;
-
(2) “84消毒液”与适量硫酸混合使用可增强消毒能力,某消毒组成员欲用盐酸代替硫酸,是否可行(填“是"或“否”),原因是;
-
(3) Cl2是最早用于饮用水消毒的物质,ClO2是一种广谱消毒剂,等质量的Cl2和ClO2消毒效率高的是(填化学式);工业上ClO2常用NaClO3和Na2SO3溶液混合酸化反应制得,反应中NaClO3和Na2SO3的物质的量之比为。
已知:25℃时NaClO溶液中HClO、 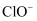 的物质的量分数随pH的分布如下图所示。
的物质的量分数随pH的分布如下图所示。

-
(1) 工业上将Cl2通入
 的NaOH溶液中制备NaClO。
的NaOH溶液中制备NaClO。 ①该反应的离子方程式为;
②当溶液
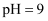 时,该溶液中主要存在的阴离子有(填化学式);
时,该溶液中主要存在的阴离子有(填化学式);③25℃时,反应
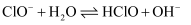 的平衡常数K=(填数值)。
的平衡常数K=(填数值)。 -
(2) 工业常用石灰乳和
 反应制取漂白粉,反应放热,温度过高时会发生副反应生成
反应制取漂白粉,反应放热,温度过高时会发生副反应生成  。反应过程中缓缓通入Cl2的目的是。
。反应过程中缓缓通入Cl2的目的是。
-
(3) 实验室将Cl2通入含水8%的
 固体中可制备Cl2O,生成的气体仅为Cl2O,该反应的化学方程式为。
固体中可制备Cl2O,生成的气体仅为Cl2O,该反应的化学方程式为。
|
实验 |
装置 |
试剂 |
现象 |
|
① |
|
紫色的石蕊试液 |
溶液先变红后褪色 |
|
② |
|
产生气泡 |
|
|
③ |
|
产生白色沉淀 |
|
|
④ |
Na2S |
产生黄色沉淀 |
由上述实验可得新制氯水的性质与对应的解释或离子方程式不相符的是( )
 B . 实验②发生的反应为
B . 实验②发生的反应为 C . 实验③说明新制氯水中有
C . 实验③说明新制氯水中有 D . 实验④体现氯气的氧化性,S2-+Cl2=S↓ +2Cl-
D . 实验④体现氯气的氧化性,S2-+Cl2=S↓ +2Cl-
 B .
B .  C .
C .  D .
D . 
 是重要的工业原料,可用于生产盐酸、漂白粉及制氯仿等有机溶剂。
是重要的工业原料,可用于生产盐酸、漂白粉及制氯仿等有机溶剂。 的制备可用下列反应:NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,下列关于氯及其化合物的性质与用途具有对应关系的是( )
的制备可用下列反应:NaClO+2HCl(浓)=NaCl+Cl2↑+H2O,下列关于氯及其化合物的性质与用途具有对应关系的是( )
 易液化,可用于生产盐酸
B . NaCl熔点较高,可用作防腐剂
C . 盐酸具有挥发性,可用于除铁锈
D . NaClO具有强氧化性,可用作漂白剂
易液化,可用于生产盐酸
B . NaCl熔点较高,可用作防腐剂
C . 盐酸具有挥发性,可用于除铁锈
D . NaClO具有强氧化性,可用作漂白剂
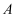

 溶液
溶液 酸化的
酸化的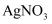 溶液
溶液


