离子反应发生的条件 知识点题库
毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

-
(1) 毒重石用盐酸浸取前需充分研磨,目的是 。实验室用37%的盐酸配置15%的盐酸,除量筒外还需使用下列仪器中的 。
a.烧杯 b.容量瓶 c.玻璃棒 d.滴定管
-
(2)

加入NH3·H2O调节pH=8可除去 (填离子符号),滤渣Ⅱ中含 (填化学式)。加入H2C2O4时应避免过量,原因是 。
已知:Ksp(BaC2O4)=1.6×10-7 , Ksp(CaC2O4)=2.3×10-9
-
(3) 利用简洁酸碱滴定法可测定Ba2+的含量,实验分两步进行。
已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ 移取xml一定浓度的Na2CrO4溶液与锥形瓶中,加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为V0mL。
步骤Ⅱ:移取y mLBaCl2溶液于锥形瓶中,加入x mL与步骤Ⅰ 相同浓度的Na2CrO4溶液,待Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为V1mL。
滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的 (填“上方”或“下方”)。BaCl2溶液的浓度为 mol·L-1 , 若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将 (填“偏大”或“偏小”)。
选项 | 操作及现象 | 溶液 |
A | 通入CO2 , 溶液不变浑浊.先通入CO2再通入氨气,溶液变浑浊 | CaCl2溶液 |
B | 通入CO2 , 溶液变浑浊.再加入品红溶液,红色褪去 | Ca(ClO)2溶液 |
C | 通 CO2 , 溶液变浑浊.继续通CO2至过量,浑浊消失 | Na2SiO3溶液 |
D | 通 CO2 , 溶液变浑浊.继续通CO2至过量,浑浊消失.再加入足量NaOH溶液,又变浑浊 | Ca(OH)2溶液 |
 ⑤S2﹣ ⑥CO
⑤S2﹣ ⑥CO  ⑦NH
⑦NH  ⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )
⑧Mg2+ ⑨Al3+ , 而事实上有部分离子不用鉴定就能加以否定,你认为不必鉴定的是( )

-
(1) 仪器1的名称。
-
(2) 除去澄清石灰水中悬浮的CaCO3颗粒应选用(填字母,下同)。
-
(3) 分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物应选用。
-
(4) 明胶是水溶性蛋白质混合物,溶于水形成胶体。分离明胶的水溶液与Na2SO4溶液应选用,设计实验证明SO42-已分离出来。
-
(5) 有一混合物的水溶液,只可能含有以下离子中的若干种;K+、NH4+、Cl-、Ba2+、CO32-、SO42- , 现取三份100mL溶液进行如下实验:①第一份加入AgNO3溶液有沉淀产生;②第二份加足量NaOH溶液加热后,收集到气体0.04mol;③第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。请根据上述实验结果,原溶液中肯定有离子,肯定无离子,可能有离子。
①蛋壳能否溶于酸 ②白酒中是否含有甲醇 ③鉴别食盐和小苏打 ④检验自来水中是否含有氯离子
| 选项 | 反应情况设想 | 评价 |
| A | 当铁、铜均不剩余时,溶液中一定有Fe2+、Cu2+ , 一定无Fe3+ | 符合题意,Fe3+和Fe、Cu均可反应 |
| B | 当铁、铜均有剩余时,溶液中一定有Fe2+、Cu2+ , 无Fe3+ | 符合题意,Fe和Cu与Fe3+都反应,故有Fe2+和Cu2+ , 无Fe3+ |
| C | 当铜有剩余,铁无剩余时,溶液中一定只有Fe2+ , 无Cu2+ | 符合题意,Cu有剩余,故无Cu2+ |
| D | 当铁有剩余,铜无剩余时,溶液中一定有Fe2+、Cu2+ | 不符合题意,不可能有Fe剩余而无Cu剩余,因为Fe比Cu优先与Fe3+反应 |
| 选项 | 分类状况 | 分类依据 |
| A | 将分散系分为胶体和非胶体 | 分散质粒子的直径大小 |
| B | 将物质分为电解质和非电解质 | 物质在水溶液中或熔融状态下是否能导电 |
| C | 将化学反应分为氧化还原反应和非氧化还原反应 | 化学反应过程中是否有元素化合价变化 |
| D | 将化学反应分为离子反应和非离子反应 | 是否有自由移动的离子参加或生成的化学反应 |
 CH3COO-+CH3CH2OH
B . NH4Fe(SO4)2溶液与足量NaOH溶液反应:Fe3++3OH-=Fe(OH)3↓
C . 漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClO-=
CH3COO-+CH3CH2OH
B . NH4Fe(SO4)2溶液与足量NaOH溶液反应:Fe3++3OH-=Fe(OH)3↓
C . 漂白粉溶液吸收少量二氧化硫气体:SO2+H2O+ClO-=  +Cl-+2H+
D . 氧化铜与稀醋酸溶液反应:CuO+2H+=Cu2++H2O
+Cl-+2H+
D . 氧化铜与稀醋酸溶液反应:CuO+2H+=Cu2++H2O
 、
、  、
、  等离子中的几种,为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如下:
等离子中的几种,为分析其成分,取此溶液分别进行了三个实验,其操作和有关现象如下: ⑴用洁净的铂丝蘸取少量溶液进行焰色反应,透过蓝色钴玻璃观察,火焰呈紫色。
⑵取少量原溶液,滴加足量 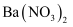 溶液,有白色沉淀产生,再滴加足量的稀硝酸,无气泡产生且沉淀不溶解,过滤得到滤液a。
溶液,有白色沉淀产生,再滴加足量的稀硝酸,无气泡产生且沉淀不溶解,过滤得到滤液a。
⑶另取少量原溶液,逐滴滴加过量的NaOH溶液,白色沉淀先增多后减少,但不完全溶解。
①原溶液中一定存在的离子有;一定不存在的离子有。
②补齐检验溶液中不能确定离子的操作:取少量滤液a,。
③写出第(3)个实验中白色沉淀减少过程中发生的离子反应方程式:。
④结合实验(3),你认为实验室制备 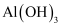 ,用可溶性铝盐和反应更佳(填化学式)。
,用可溶性铝盐和反应更佳(填化学式)。
实验1:向烧杯依次加入下列试剂,记录灯泡变化 | |
| ①氢氧化钡粉末:灯泡不亮 ②加入蒸馏水:灯泡变亮 ③逐滴滴加稀硫酸,灯泡变化如下: 亮 |
-
(1) 氢氧化钡与硫酸在溶液中能发生(填字母)反应。
a.复分解反应 b.氧化还原反应 c.置换反应
-
(2) 加水后,灯泡变亮的原因是氢氧化钡发生了。
-
(3) 用离子方程式解释过程Ⅰ中灯泡变暗的原因。
-
(4) 实验2:用硫酸钠溶液替代稀硫酸,重复实验进行对照。
①硫酸钠溶液中
 的浓度与稀硫酸中
的浓度与稀硫酸中 的浓度(填“相等”或“不相等”)。
的浓度(填“相等”或“不相等”)。②加入硫酸钠溶液过程中灯泡不熄灭,原因是。
 的物质是酸,给出质子的能力越强,酸性越强。已知:
的物质是酸,给出质子的能力越强,酸性越强。已知: ,
,  , 下列酸性强弱顺序正确的是( )
, 下列酸性强弱顺序正确的是( )
 B .
B .  C .
C .  D .
D . 

 暗
暗 熄灭
熄灭 亮
亮


