离子反应发生的条件 知识点题库
下列各组离子中,在碱性溶液中能大量共存,且溶液为无色透明的是( )
A . K+、MnO 、Cl-、SO
、Cl-、SO B . Na+、CO
B . Na+、CO 、SO
、SO 、Cl-
C . NO
、Cl-
C . NO 、Na+、HCO
、Na+、HCO 、Ba2+
D . Na+ 、NO
、Ba2+
D . Na+ 、NO 、H+、SO
、H+、SO
 、Cl-、SO
、Cl-、SO B . Na+、CO
B . Na+、CO 、SO
、SO 、Cl-
C . NO
、Cl-
C . NO 、Na+、HCO
、Na+、HCO 、Ba2+
D . Na+ 、NO
、Ba2+
D . Na+ 、NO 、H+、SO
、H+、SO
有一未知的无色溶液,只可能含有以下离子中的若干种(忽略由水电离产生的H+、OH﹣):H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3﹣、CO32﹣ , 现取样逐滴滴加NaOH溶液,测得沉淀与NaOH溶液的体积关系如图.以下推测错误的是( )

A . 原溶液一定不存在H+、Cu2+、CO  B . 不能确定原溶液是否含有K+、NO
B . 不能确定原溶液是否含有K+、NO  C . 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D . 实验所加的NaOH溶液浓度为2mol/L
C . 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D . 实验所加的NaOH溶液浓度为2mol/L
 B . 不能确定原溶液是否含有K+、NO
B . 不能确定原溶液是否含有K+、NO  C . 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D . 实验所加的NaOH溶液浓度为2mol/L
C . 原溶液中n(Mg2+):n(Al3+):n(NH4+)=1:1:2
D . 实验所加的NaOH溶液浓度为2mol/L
制印刷电路时常用氯化铁溶液作为“腐蚀液”,发生的反应为2FeCl3+Cu=2FeCl2+CuCl2向盛有氯化铁溶液的烧杯中同时加入铁粉和铜粉,反应结束后,在烧杯中下列结果不可能出现的是( )
A . 有铜无铁
B . 有铁无铜
C . 铁、铜都有
D . 铁、铜都无
下列物质中,既可与盐酸反应,又可与氢氧化钠溶液反应的是( )
A . NaHSO4
B . NaHCO3
C . Na2SO3
D . NH4NO3
在含有Fe3+、Al3+、Fe2+、NH4+的溶液中,加入足量的Na202固体,充分反应后,再加入过量的稀盐酸,完全反应后,溶液中离子数目没有变化的是( )
A . Fe3+
B . Fe2+
C . Al3+
D . N 

将HCl、H2SO4、Ba(NO3)2三种溶液,按一定顺序滴入到Na2CO3溶液中至恰好完全反应有以下现象:
①加入A时生成白色沉淀;
②往①沉淀中加入B时沉淀溶解,并有气体逸出;
③往②生成的溶液中加入C时,又有白色沉淀生成.
根据上述现象,回答:
-
(1) A、B、C各是什么溶液?(填溶质的化学式)
A. B. C.
-
(2) 写出上述①②反应的离子方程式..
向溶液X中持续通入气体Y,会产生“浑浊→澄清”现象的是( )
A . X:氯化铝溶液,Y:氨气
B . X:硅酸钠溶液,Y:二氧化硫
C . X:氢氧化钡溶液,Y:一氧化碳
D . X:四羟基合铝酸钠溶液,Y:二氧化氮
在五种饱和溶液①Ba(NO3)2 ②Ca(OH)2 ③Na2SiO3 ④NaAlO2 ⑤Na2CO3中,分别通入足量的CO2 , 最终能得到沉淀或析出晶体的是( )
A . ①②③
B . ①③④
C . ②③④
D . ③④⑤
将足量的CO2通入下列溶液中,能产生沉淀的是( )
A . 硅酸钠溶液
B . 石灰水
C . 次氯酸钠溶液
D . 氯化钙溶液
往200mLFeCl3溶液中通入4.48L标难状况下的H2S气体后(气体完全反应),再加入过量的Fe粉,反应停止后,测得溶液中含有1.2mol金属阳离子,下列说法正确的是( )
A . 通入H2S时发生反应的离子方程式为Fe3++H2S=Fe2++S↓+2H+
B . 若将加入Fe粉后溶液中的1.2mol金属阳离子完全氧化,需要通入Cl213.44L
C . 若将上述4.48L标准状况下的H2S换成0.2molNa2S,加入过量的Fe粉后溶液中也能得到1.2mol金属阳离子
D . 将原FeCl3溶液加热蒸干并灼烧,得到固体的质量为64g
某白色固体可能由①NH4Cl、②AlCl3、③NaCl、④AgNO3、⑤KOH中的一种或几种组成,此固体投入水中得澄清溶液,该溶液可使酚酞呈红色,若向溶液中加稀硝酸到过量,有白色沉淀产生。则对原固体的判断错误的是( )
A . 肯定存在①
B . 至少存在②和⑤
C . 无法确定是否有③
D . 至少存在①、④、⑤
离子方程式BaCO3 + 2H+ = CO2↑+ H2O + Ba2+ 中的H+ 不能代表的物质是( )
①HCl ②H2SO4 ③HNO3 ④NaHSO4 ⑤CH3COOH
A . ②④⑤
B . ④⑤
C . ①③
D . ⑤
在强酸性溶液中能大量共存的无色透明离子组是( )
A . K+、Na+、NO  、MnO
、MnO  B . Mg2+、Na+、Cl-、SO
B . Mg2+、Na+、Cl-、SO  C . K+、Na十、Br-、Cu2+
D . Na十、Ba2+、OH-、SO 4 2 −
C . K+、Na十、Br-、Cu2+
D . Na十、Ba2+、OH-、SO 4 2 −
 、MnO
、MnO  B . Mg2+、Na+、Cl-、SO
B . Mg2+、Na+、Cl-、SO  C . K+、Na十、Br-、Cu2+
D . Na十、Ba2+、OH-、SO 4 2 −
C . K+、Na十、Br-、Cu2+
D . Na十、Ba2+、OH-、SO 4 2 −
某小组在验证反应“Fe+2Ag+=Fe2++2Ag”的实验中检测到Fe3+ , 发现和探究过程如下。向硝酸酸化的0.05mol/L硝酸银溶液(pH≈2)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
[资料:i.Ag+与SCN-生成白色沉淀AgSCN,ⅱ:3Fe2++2[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓(蓝色)]
-
(1) 检验产物: ①取出少量黑色固体,洗涤后,(填操作和现象)。证明黑色固体中含有Ag.
②取上层清液,滴加K3[Fe(CN)6]溶液,产生蓝色沉淀,说明溶液中含有。
-
(2) 针对“溶液呈黄色”,甲认为溶液中有Fe3+ , 乙认为铁粉过量时不可能有Fe3+ , 乙依据的原理是(用离子方程式表示)。针对两种观点继续实验:
① 取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号
取样时间/min
现象
i
3
产生大量白色沉淀: 溶液呈红色
ii
30
产生白色沉淀;较3min时量少;溶液红色较3min时加深
ⅲ
120
产生白色沉淀: 较30min时量少;溶液红色较30min时变浅
②对Fe3+产生的原因作出如下假设:
假设a: 可能是铁粉表面有氧化层,能产生Fe3+;
假设b: 空气中存在O2 , 由于(用离子方程式表示),可产生Fe3+;
假设c: 酸性溶液中NO3-具有氧化性,可产生Fe3+;
假设d: 根据现象,判断溶液中存在Ag+ , 可产生Fe3+。
有些离子方程式能表示一类反应,有些离子方程式却只能表示一个反应。下列离子方程式中,只能表示一个化学反应的是( )
A . OH-+HCO3-=CO32—+H2O
B . Cl2+H2O  H++Cl-+HClO
C . CO32—+2H+=CO2↑+H2O
D . Ag++Cl-=AgCl↓
H++Cl-+HClO
C . CO32—+2H+=CO2↑+H2O
D . Ag++Cl-=AgCl↓
 H++Cl-+HClO
C . CO32—+2H+=CO2↑+H2O
D . Ag++Cl-=AgCl↓
H++Cl-+HClO
C . CO32—+2H+=CO2↑+H2O
D . Ag++Cl-=AgCl↓
下列实验过程中,始终无明显现象的是( )
A . SO2通入CaCl2溶液中
B . CO2通入饱和Na2CO3溶液中
C . NH3通入AlCl3溶液中
D . NO2通入FeSO4溶液中
下列各组离子在给定条件下一定能大量共存的是( )
A . 强酸性溶液中:H+、NO  、SO
、SO  B . pH=12的溶液中:OH-、K+、Cl-、HCO
B . pH=12的溶液中:OH-、K+、Cl-、HCO  C . 加入铝粉能放出氢气的溶液中一定存在:NH
C . 加入铝粉能放出氢气的溶液中一定存在:NH  、NO
、NO  、AlO
、AlO  、SO
、SO  D . 25℃时pH=7的无色溶液中:Na+、Cl-、SO
D . 25℃时pH=7的无色溶液中:Na+、Cl-、SO  、K+
、K+
 、SO
、SO  B . pH=12的溶液中:OH-、K+、Cl-、HCO
B . pH=12的溶液中:OH-、K+、Cl-、HCO  C . 加入铝粉能放出氢气的溶液中一定存在:NH
C . 加入铝粉能放出氢气的溶液中一定存在:NH  、NO
、NO  、AlO
、AlO  、SO
、SO  D . 25℃时pH=7的无色溶液中:Na+、Cl-、SO
D . 25℃时pH=7的无色溶液中:Na+、Cl-、SO  、K+
、K+
下列方程式与所给事实不相符的是( )
A . 用小苏打治疗胃酸过多:HCO +H+=CO2↑+H2O
B . 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=2Fe2++Cu2+
C . 铝粉和氧化铁组成的铝热剂用于焊接钢轨:2Al+Fe2O3
+H+=CO2↑+H2O
B . 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=2Fe2++Cu2+
C . 铝粉和氧化铁组成的铝热剂用于焊接钢轨:2Al+Fe2O3 Al2O3+2Fe
D . 向沸水中滴加FeCl3溶液制Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
Al2O3+2Fe
D . 向沸水中滴加FeCl3溶液制Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
 +H+=CO2↑+H2O
B . 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=2Fe2++Cu2+
C . 铝粉和氧化铁组成的铝热剂用于焊接钢轨:2Al+Fe2O3
+H+=CO2↑+H2O
B . 用FeCl3溶液腐蚀印刷电路板:2Fe3++Cu=2Fe2++Cu2+
C . 铝粉和氧化铁组成的铝热剂用于焊接钢轨:2Al+Fe2O3 Al2O3+2Fe
D . 向沸水中滴加FeCl3溶液制Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
Al2O3+2Fe
D . 向沸水中滴加FeCl3溶液制Fe(OH)3胶体:Fe3++3H2O=Fe(OH)3↓+3H+
某溶液由Na+、Mg2+、Ba2+、Fe3+、HCO 、SO
、SO 、Cl-中的若干种离子组成,且所有离子物质的量浓度相等,取适量该溶液进行如下实验:
、Cl-中的若干种离子组成,且所有离子物质的量浓度相等,取适量该溶液进行如下实验:
 、SO
、SO 、Cl-中的若干种离子组成,且所有离子物质的量浓度相等,取适量该溶液进行如下实验:
、Cl-中的若干种离子组成,且所有离子物质的量浓度相等,取适量该溶液进行如下实验: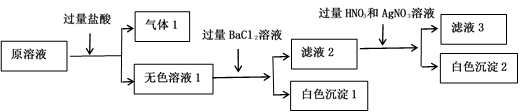
根据以上实验判断,下列推断不正确的是( )
A . 少量气体1通入澄清石灰水中,溶液变浑浊
B . 白色沉淀1中加稀硝酸,沉淀不溶解
C . 原溶液中一定存在Na+、Mg2+ , 可能存在Cl-
D . 滤液2中加入足量碳酸钠溶液会产生白色沉淀
侯德榜先生于1943年创立了“侯氏制碱法”。该工艺中一般不涉及的离子反应是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
最近更新



