电解质在水溶液中的电离 知识点题库
 盐酸;
盐酸; 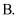 硫酸;
硫酸;  醋酸三种酸的稀溶液
醋酸三种酸的稀溶液  用a、b、c、
用a、b、c、  、
、  、
、  号填写
号填写 
 当其物质的量浓度相同时,
当其物质的量浓度相同时,  由大到小的顺序是,
由大到小的顺序是,
 同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是,
同体积同物质的量浓度的三种酸,中和NaOH能力由大到小的顺序是,
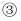 当其
当其  相同时,物质的量浓度由大到小的顺序为,
相同时,物质的量浓度由大到小的顺序为,
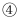 当
当  相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气
相同、体积相同时,同时加入形状、质量、密度相同的锌,若产生相同体积的氢气  相同状况
相同状况  ,则开始时反应速率的大小关系是.
,则开始时反应速率的大小关系是.
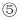 将
将  相同的三种酸均加水稀释至原来的10倍,
相同的三种酸均加水稀释至原来的10倍,  由大到小的顺序为.
由大到小的顺序为.

-
(1) ①燃料电池是一种绿色环保、高效的化学电源。上图为甲醇燃料电池,则负极反应式为。
②用甲醇燃料电池电解300mL饱和食盐水,则电解的化学方程式为。电解一段时间后,当溶液的pH值为13时,消耗O2的质量为g。(忽略溶液体积变化,不考虑损耗)
③用甲醇燃料电池电解2L,1mol/L硫酸铜溶液,一段时间后:两极共收集到标准状况下的气体89.6L,则电路中共转移mol电子。
-
(2) 利用电化学原理,将NO2、O2和熔融KNO3制成燃料电池,模拟工业电解法来处理含Cr2O72-废水,如下图所示;电解过程中溶液发生反应:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O。

①甲池工作时,NO2转变成绿色硝化剂Y,Y是N2O5 , 可循环使用,则石墨Ⅱ附近发生的电极反应式为。
②向完全还原为Cr3+的乙池工业废水中滴加NaOH溶液,可将铬以Cr(OH)3沉淀的形式除去,已知Cr(OH)3存在以下溶解平衡:Cr(OH)3(s)
 Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=1.0×10-32 , 要使c(Cr3+)降至10-5mol•L-1 , 溶液的pH应调至。
Cr3+(aq)+3OH-(aq),常温下Cr(OH)3的溶度积Ksp=c(Cr3+)•c3(OH-)=1.0×10-32 , 要使c(Cr3+)降至10-5mol•L-1 , 溶液的pH应调至。
 ]。下列叙述不正确的是( )
]。下列叙述不正确的是( )
-
(1) 把Cl2通入浓氨水中,发生如下反应:3Cl2 + 8NH3 = 6NH4Cl + N2
①用双线桥表示反应的电子转移方向和数目:
②反应中发生电子转移的Cl2与NH3的分子数之比为:
③若反应中有6.8克氨气发生氧化反应,则反应中有生成氮气的质量为
-
(2) 已知NaHSO4通常为晶体且易溶于水,它的水溶液与KOH溶液反应的离子方程式可以用H++OH- = H2O来表示,请回答下列问题:
①写出NaHSO4在水溶液中的电离方程式
②NaHSO4属于(填“酸”、“碱”或“盐”)。
③向NaHSO4溶液中,逐滴加入Ba(OH)2溶液至中性,请写出发生反应的离子方程式:,此时溶液中的溶质为(填化学式),所得溶液的导电性比最初溶液的导电性。(填“增强”、“减弱”或“不变”)。
-
(1) 取冰醋酸配制250mL 0.4mol/L的醋酸溶液,用0.4mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对该醋酸溶液的浓度进行标定。
①将一定质量的冰醋酸加水稀释过程中,溶液的导电能力变化如图所示。解稀释过程中a、b、c点对应溶液的pH由大到小的顺序为。

②为标定稀释所得醋酸溶液的准确浓度,用0.2000mol/L的NaOH标准溶液对20.00mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如表:
实验序号
1
2
3
4
消耗NaOH溶液的体积(mL)
20.05
20.00
18.80
19.95
该醋酸溶液的准确浓度为mol/L。上述标定过程中,会造成测定结果偏高的原因可能是(填字母)。
A.未用标准液润洗碱式滴定管
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装待测液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
-
(2) 该小组同学探究浓度对醋酸电离程度的影响时,用pH计测定25℃时不同浓度醋酸的pH,其结果如表:
醋酸浓度(mol/L)
0.0010
0.0100
0.0200
0.1000
0.2000
pH
3.88
3.38
3.23
2.88
2.73
①根据表中数据,可得出醋酸是弱电解质的结论,你认为得出此结论的依据是。
②从表中数据还可得出另一结论:随着醋酸浓度的增大,醋酸的电离程度将(填“增大”、“减小”或“不变”)。
③利用水解理论设计实验证明醋酸的酸性比碳酸的强:。

 +c(OH-)=
+c(OH-)= +c(H+)
B . 该体系中,c(NH3·H2O)-c(HCOOH)=c(NH
+c(H+)
B . 该体系中,c(NH3·H2O)-c(HCOOH)=c(NH )-c(HCOO-)
C . N点时,c(HCOO-)=c(NH
)-c(HCOO-)
C . N点时,c(HCOO-)=c(NH )>c(H+)=c(OH-)
D . M点时,pH=6.5
)>c(H+)=c(OH-)
D . M点时,pH=6.5
①Na2O、MgO、Al2O3均属于碱性氧化物
②已知氧化铝在熔融状态下能导电,则氧化铝在熔融状态下能电离
③0.5mol/L所有一元酸中氢离子浓度都是0.5mol/L
④苏打、碱石灰、醋酸、小苏打均为电解质
⑤电解质溶液导电的原因是溶液中有自由移动的阴阳离子
⑥熔融的电解质都能导电

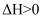 。回答下列问题:
。回答下列问题:
-
(1) 25℃时常压下,在pH=5的稀醋酸溶液中,c(CH3COO-)=mol/L(写出精确值)。下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是(填字母)。
a.加入少量0.10 mol/L的稀盐酸 b.加热该CH3COOH溶液
c.加入少量纯CH3COOH d.加水稀释至0.010 mol/L
e.加入少量氯化钠晶体 f.加入少量0.10 mol/L的NaOH溶液
-
(2) 将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)(填“>”、“<”或“=”,下同)V(醋酸)。
-
(3) 25℃下,向体积为
 的醋酸溶液中滴加
的醋酸溶液中滴加 的
的 溶液,溶液恰好呈中性,则Va与Vb的关系是:VaVb (填“>”、“<”或“=”)。
溶液,溶液恰好呈中性,则Va与Vb的关系是:VaVb (填“>”、“<”或“=”)。
-
(4) 已知90℃时,水的离子积常数为
 , 在此温度下将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合后溶液(温度保持90℃)中的c(H+)=(保留三位有效数字)mol/L
, 在此温度下将pH=3的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合后溶液(温度保持90℃)中的c(H+)=(保留三位有效数字)mol/L
-
(5) 若25℃时CH3COOH的电离平衡常数
 , 向a LCH3COOH溶液中加入b mol CH3COONa,恢复至25℃,混合液呈中性,则原CH3COOH溶液的浓度为mol/L。
, 向a LCH3COOH溶液中加入b mol CH3COONa,恢复至25℃,混合液呈中性,则原CH3COOH溶液的浓度为mol/L。
 溶液的过程中,溶液中随着水量的加入而减小的是( )
溶液的过程中,溶液中随着水量的加入而减小的是( )
 B .
B .  C .
C .  D .
D . 
 且
且 相同的
相同的 和
和 加水稀释,溶液中
加水稀释,溶液中 随着加水量的变化曲线如图所示:
随着加水量的变化曲线如图所示: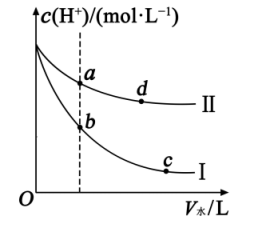
回答下列问题
-
(1) Ⅱ表示的是(填化学式)的变化曲线.
-
(2) a点溶液的导电性b点溶液的导电性(填“<”“>”或“=”,下同),a点酸的电离程度d点酸的电离程度,a点对应酸的总浓度b点对应酸的总浓度.
-
(3) 取等体积的b、c两点对应的溶液与相同浓度的
 溶液反应,消耗
溶液反应,消耗 溶液的体积关系是
溶液的体积关系是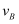
 (填“<”“>”或“=”).
(填“<”“>”或“=”).



