电解质在水溶液中的电离 知识点题库
下列各种说法中,正确的是( )
A . 所有的盐电离时只能生成酸根阴离子和金属阳离子
B . 只由一种分子组成的物质一定为纯净物,组成混合物的物质可能只有一种元素
C . 氧化物是指含有氧元素的化合物,如NaOH、H2SO4等
D . 氨气溶于水溶液显碱性,所以氨气属于碱
“电解质的溶液中所有阳离子所带的正电荷数与所有阴离子所带的负电荷数相等,故显电中性,常称电荷守恒”.某盐的溶液中含有Na+、Mg2+、Cl﹣、SO  四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣ 为0.4mol,则SO
四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣ 为0.4mol,则SO  物质的量为( )
物质的量为( )
 四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣ 为0.4mol,则SO
四种离子,若Na+为0.2mol,Mg2+为0.4mol,Cl﹣ 为0.4mol,则SO  物质的量为( )
物质的量为( )
A . 0.1mol
B . 0.3mol
C . 0.5mol
D . 0.15mol
酸具有共同的性质,是因为( )
A . 都能电离出氢离子
B . 都能使石蕊试液变红
C . 都能跟碱反应生成盐和水
D . 都含有氧元素
下列图象所表示的化学知识中,不正确的是( )
A .  分散系的分类
B .
分散系的分类
B .  稀释浓氢氧化钠溶液的过程
C .
稀释浓氢氧化钠溶液的过程
C .  向碳酸钠溶液中逐滴滴加盐酸
D .
向碳酸钠溶液中逐滴滴加盐酸
D .  向偏铝酸钠溶液中逐滴滴加盐酸
向偏铝酸钠溶液中逐滴滴加盐酸
 分散系的分类
B .
分散系的分类
B .  稀释浓氢氧化钠溶液的过程
C .
稀释浓氢氧化钠溶液的过程
C .  向碳酸钠溶液中逐滴滴加盐酸
D .
向碳酸钠溶液中逐滴滴加盐酸
D .  向偏铝酸钠溶液中逐滴滴加盐酸
向偏铝酸钠溶液中逐滴滴加盐酸
常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示:
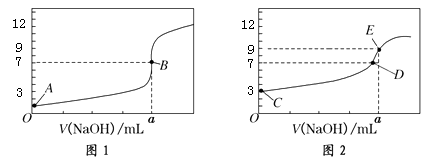
以下说法正确的是( )
A . 图1是滴定CH3COOH 溶液的曲线
B . 图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色
C . 点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D . 如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1∶100
中和相同体积、相同pH的Ba(OH)2、NaOH、NH3•H2O三种溶液,所用相同浓度的盐酸的体积分别是V1、V2、V3 , 则三者的关系是( )
A . V1=V2=V3
B . V1>V2>V3
C . V3>V1>V2
D . V1=V2<V3
25℃时,下列溶液中,离子浓度关系正确的是()
A . 将amol·L-1CH3COOH与bmol·L-1NaOH溶液等体积混合,测得溶液pH为7,则a与b的关系:a>b
B . 浓度相同的①NH4Cl;②CH3COONH4;③NH4HSO4。三种溶液中的c(NH4+):①>③>②
C . 将相同浓度的氨水与盐酸等体积混合,所得溶液中的离子浓度关系:c(NH4+)>c(Cl-)>c(H+)>c(OH-)
D . pH相等的四种溶液a.CH3COONa;b.C6H5ONa;c. NaHCO3;d.NaOH。其溶质物质的量浓度由小到大的顺序为d<b<a<c
室温下,相同浓度、体积相同的盐酸和醋酸溶液,下列说法正确的是()
A . 两者水的电离程度相同
B . 分别用水稀释相同倍数后,c(Cl-)>c(CH3COO-)
C . 盐酸的pH值大于醋酸溶液的pH值
D . 分别与物质的量浓度相同的NaOH溶液恰好反应完全时,盐酸消耗NaOH溶液的体积多
常温下,0.1 mol·L-1某一元酸(HA)溶液中c(OH-)/c(H+)=1×10-8 , 下列叙述正确的是( )
A . 该一元酸溶液的pH=1
B . 该溶液中由水电离出的c(H+)=1×10-11mol·L-1
C . 该溶液中水电离的c(H+)=1×10-3 mol·L-1
D . 用pH=11的NaOH溶液V1 L和V2 L 0.1 mol·L-1该一元酸(HA)溶液混合,若恰好反应,则V1=V2
向0. 02 mol.L-1 CuSO4溶液中匀速滴加1 mol.L-1氨水,先观察到有浅蓝色沉淀[Cu2(OH)2SO4]生成,后沉淀溶解,逐渐变为深蓝色溶液。该实验过程体系的pH和电导率随时间的变化如右图所示。下列说法正确的是( )

A . c(Cu2+):a点=b点
B . bc段生成浅蓝色沉淀的反应为  C . d点时:
C . d点时:  D . 导电能力:
D . 导电能力: 
 C . d点时:
C . d点时:  D . 导电能力:
D . 导电能力: 
下列物质属于电解质,且溶于水为酸性的是( )
A . NaOH
B . CO2
C . NaHSO4
D . 盐酸
在NaHS溶液中,存在多种微粒,下列关系中错误的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
常温下,在pH=5的HA溶液中存在电离平衡:HA  A-+H+ , 对于该平衡,下列叙述正确的是( )
A-+H+ , 对于该平衡,下列叙述正确的是( )
 A-+H+ , 对于该平衡,下列叙述正确的是( )
A-+H+ , 对于该平衡,下列叙述正确的是( )
A . 加入水时,平衡向右移动,HA电离常数增大.
B . 加入少量NaA固体,平衡向右移动
C . 稍微升高溶液温度,溶液中的c(OH-)增大
D . 加入少量NaOH固体,平衡向右移动,c(H+)减少
向NaOH溶液中缓慢通入CO2气体,溶液中CO  的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( )
的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( )
 的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( )
的物质的量与通入CO2物质的量的关系如图。下列关于图中a、b、c三点溶液的说法错误的是( ) 
A . a、b、c三点溶液都满足:c(Na+)+c(H+)=c(HCO  )+2c(CO
)+2c(CO  )+c(OH-)
B . a、b、c三点溶液中水的电离程度:a=b<c
C . a、b两点溶液的pH满足:pH(a)>pH(b)
D . b点溶液满足:c(Na+)>c(HCO
)+c(OH-)
B . a、b、c三点溶液中水的电离程度:a=b<c
C . a、b两点溶液的pH满足:pH(a)>pH(b)
D . b点溶液满足:c(Na+)>c(HCO  )>c(CO
)>c(CO  )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
 )+2c(CO
)+2c(CO  )+c(OH-)
B . a、b、c三点溶液中水的电离程度:a=b<c
C . a、b两点溶液的pH满足:pH(a)>pH(b)
D . b点溶液满足:c(Na+)>c(HCO
)+c(OH-)
B . a、b、c三点溶液中水的电离程度:a=b<c
C . a、b两点溶液的pH满足:pH(a)>pH(b)
D . b点溶液满足:c(Na+)>c(HCO  )>c(CO
)>c(CO  )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
下列说法错误的是( )
A . 升高HCl稀溶液温度,溶液中c(H+)不变
B . 常温,向醋酸钠溶液中滴加少量醋酸使其pH=7,则混合液中:c(Na+)=c(CH3COO-)
C . 向AgCl、AgBr的饱和溶液中加入少量AgNO3固体,溶液中氯离子浓度和溴离子浓度比不变
D . 25℃时,将0.1mol·L-1的NaOH溶液加水稀释100倍,所得溶液的pH=11.0
图为NaCl在水中的溶解和电离示意图。下列说法正确的是( )

A . NaCl溶液为强电解质
B . a离子为Na+ , b离子为Cl-
C . NaCl的电离方程式为:NaCl=Na++Cl-
D . NaCl的溶解可以在容量瓶中进行
下列有关叙述正确的是( )
A . 常温下,等体积的 的盐酸与
的盐酸与 的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计)
B . 室温下,pH均为4的稀硫酸、
的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计)
B . 室温下,pH均为4的稀硫酸、 溶液中,水的电离程度相同
C . 25℃时,
溶液中,水的电离程度相同
C . 25℃时, 的HA溶液中
的HA溶液中 , 则该溶液中由水电离出的
, 则该溶液中由水电离出的 D . 在饱和AgCl、AgBr的混合溶液中加入少量
D . 在饱和AgCl、AgBr的混合溶液中加入少量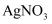 溶液,
溶液, 增大
增大
 的盐酸与
的盐酸与 的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计)
B . 室温下,pH均为4的稀硫酸、
的氢氧化钡溶液混合,所得溶液的pH=13(设混合后溶液总体积的变化忽略不计)
B . 室温下,pH均为4的稀硫酸、 溶液中,水的电离程度相同
C . 25℃时,
溶液中,水的电离程度相同
C . 25℃时, 的HA溶液中
的HA溶液中 , 则该溶液中由水电离出的
, 则该溶液中由水电离出的 D . 在饱和AgCl、AgBr的混合溶液中加入少量
D . 在饱和AgCl、AgBr的混合溶液中加入少量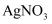 溶液,
溶液, 增大
增大
常温下,下列溶液中的离子浓度关系正确的是( )
A .  的NaHSO3溶液中,
的NaHSO3溶液中, B .
B . 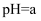 的醋酸或盐酸分别稀释10倍的pH均为
的醋酸或盐酸分别稀释10倍的pH均为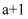 C .
C . 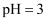 的盐酸与
的盐酸与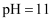 的氨水以任意比例混合后,溶液中
的氨水以任意比例混合后,溶液中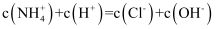 D . 向
D . 向 的氨水中加入少量水,溶液中
的氨水中加入少量水,溶液中 减小
减小
 的NaHSO3溶液中,
的NaHSO3溶液中, B .
B . 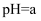 的醋酸或盐酸分别稀释10倍的pH均为
的醋酸或盐酸分别稀释10倍的pH均为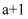 C .
C . 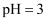 的盐酸与
的盐酸与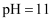 的氨水以任意比例混合后,溶液中
的氨水以任意比例混合后,溶液中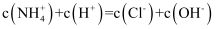 D . 向
D . 向 的氨水中加入少量水,溶液中
的氨水中加入少量水,溶液中 减小
减小
乙酸是一种一元有机弱酸,为食醋的主要成分。下列实验事实不能证明乙酸是弱酸的是( )
A . 乙酸钠溶液显碱性
B . 等体积、等 的盐酸和乙酸溶液分别与同样大小的锌粒反应,最初产生氢气的速率相等
C . 常温下,测得
的盐酸和乙酸溶液分别与同样大小的锌粒反应,最初产生氢气的速率相等
C . 常温下,测得 的乙酸溶液的
的乙酸溶液的 D . 相同条件下,等浓度的盐酸和乙酸溶液的导电性:盐酸>乙酸溶液
D . 相同条件下,等浓度的盐酸和乙酸溶液的导电性:盐酸>乙酸溶液
 的盐酸和乙酸溶液分别与同样大小的锌粒反应,最初产生氢气的速率相等
C . 常温下,测得
的盐酸和乙酸溶液分别与同样大小的锌粒反应,最初产生氢气的速率相等
C . 常温下,测得 的乙酸溶液的
的乙酸溶液的 D . 相同条件下,等浓度的盐酸和乙酸溶液的导电性:盐酸>乙酸溶液
D . 相同条件下,等浓度的盐酸和乙酸溶液的导电性:盐酸>乙酸溶液
下列实验操作及现象与推论解释不相符的是( )
选项 | 操作及现象 | 推论或解释 |
A | 电解CuCl2溶液,阴极得到Cu; 电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>H+>Na+ |
B | 用同浓度NaOH溶液滴定等体积等pH的HCl与CH3COOH溶液,后者消耗NaOH溶液体积多 | HCl在水中完全电离,CH3COOH在水溶液中存在电离平衡 |
C | 用pH计测定相同浓度的CH3COONa溶液和NaClO溶液的pH,前者的pH小于后者的 | HClO的酸性弱于CH3COOH |
D | 将固体CaSO4加入饱和Na2CO3溶液中,一段时间后,检验固体成分为CaCO3 | 相同温度下溶解度:CaSO4 < CaCO3 |
A . A
B . B
C . C
D . D
最近更新



