电解质在水溶液中的电离 知识点题库
下列有关水的叙述正确的是( )
A . 水是一种非电解质
B . 纯水中c(H+)随着温度的升高而降低
C . 由液态水结成冰的过程是一个熵增的过程
D . 25℃,pH相同的氢氧化钠溶液与醋酸钠溶液,水的电离度前者小于后者
一定温度下,某NaCl稀溶液中c(H+)为1×10-6 mol·L-1 , 下列说法正确的是
A . 该NaCl溶液显酸性
B . 该NaCl溶液中Kw=1×10-14
C . 该NaCl溶液稀释10倍后pH=7
D . 该NaCl溶液中Kw=1×10-12
下列物质中含有自由移动的Cl﹣是( )
A . KClO3溶液
B . KCl溶液
C . 液态HCl
D . NaCl固体
某混合溶液由两种或三种物质溶于水制成,且在溶液中一定满足如下关系:c(K+)=c(Cl﹣),c(Na+)=2c(SO42﹣).则溶质可能是( )
A . KCl、Na2SO4
B . KCl、Na2SO4、NaCl
C . NaCl、Na2SO4、K2SO4
D . KCl、K2SO4、Na2SO4
下列图示与对应的叙述相符的是( )

A . 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化
B . 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液
C . 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOH
D . 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大
下列有关电解质溶液的叙述正确的是( )
A . 室温时,Ka=1×10-5浓度为0.1mol/L 的HA 溶液,pH=3
B . 向0.10mol·L-1NH4HCO3溶液中通CO2至溶液pH=7:c(NH4+)=c(HCO3-)+c(CO32-)
C . 在饱和AgCl、AgBr的混合溶液中加入少量AgNO3溶液  增大
D . 25℃时,向20mL0.01mol/L的醋酸溶液中滴加10mL0.01mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)3COOH)+c(OH-)
增大
D . 25℃时,向20mL0.01mol/L的醋酸溶液中滴加10mL0.01mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)3COOH)+c(OH-)
 增大
D . 25℃时,向20mL0.01mol/L的醋酸溶液中滴加10mL0.01mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)3COOH)+c(OH-)
增大
D . 25℃时,向20mL0.01mol/L的醋酸溶液中滴加10mL0.01mol/L的KOH溶液,混合溶液后呈酸性:c(K+) + c(H+)3COOH)+c(OH-)
关于小苏打(NaHCO3)溶液的表述错误的是( )
A . c(Na+)=c(HCO3-)+ c(CO32-)+c(H2CO3)
B . c(Na+)+c(H+)=c(HCO3-)+ 2c(CO32-)+c(OH-)
C . HCO3-的电离程度大于其水解程度
D . c(Na+)>c(HCO3-) >c(OH-)>c(CO32-)
下列化学用语正确的是( )
A . H2SO3的电离方程式:H2SO3  2H++SO32-
B . NaHSO4在水溶液中的电离方程式:NaHSO4= Na++H++SO42-
C . Na2CO3的水解方程式:CO32-+2H2O
2H++SO32-
B . NaHSO4在水溶液中的电离方程式:NaHSO4= Na++H++SO42-
C . Na2CO3的水解方程式:CO32-+2H2O  H2CO3+2OH-
D . HS-的水解方程式:HS-+ H2O
H2CO3+2OH-
D . HS-的水解方程式:HS-+ H2O  H3O++S2-
H3O++S2-
 2H++SO32-
B . NaHSO4在水溶液中的电离方程式:NaHSO4= Na++H++SO42-
C . Na2CO3的水解方程式:CO32-+2H2O
2H++SO32-
B . NaHSO4在水溶液中的电离方程式:NaHSO4= Na++H++SO42-
C . Na2CO3的水解方程式:CO32-+2H2O  H2CO3+2OH-
D . HS-的水解方程式:HS-+ H2O
H2CO3+2OH-
D . HS-的水解方程式:HS-+ H2O  H3O++S2-
H3O++S2-
电解质溶液电导率越大导电能力越强,常温下用0.100 mol/L盐酸分别滴定10.00 mL浓度均为0.100 mol/L的NaOH溶液和氨水。利用传感器测得滴定过程中溶液的电导率如图所示,下列说法错误的是( )

A . 曲线②代表滴定氢氧化钠溶液的曲线
B . 滴定氨水的过程应该选择甲基橙作为指示剂
C . b点溶液中:c(H+)<c(OH-)+c(NH4+)+c(NH3·H2O)
D . a、b、c、d四点的溶液中,水的电离程度最大的是a点
常温下,用一定浓度的盐酸滴定某浓度的氨水。滴定终点附近溶液的pH和导电能力的变化如图所示(利用溶液导电能力的变化可判断滴定终点,溶液总体积变化忽略不计)。下列说法错误的是( )

A . a点对应的溶液中: 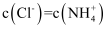 B . a→b过程中,
B . a→b过程中,  不断增大
C . c→d溶液导电性增强的主要原因是
不断增大
C . c→d溶液导电性增强的主要原因是  和
和  增大
D . 根据溶液pH和导电能力的变化可判断:
增大
D . 根据溶液pH和导电能力的变化可判断: 
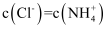 B . a→b过程中,
B . a→b过程中,  不断增大
C . c→d溶液导电性增强的主要原因是
不断增大
C . c→d溶液导电性增强的主要原因是  和
和  增大
D . 根据溶液pH和导电能力的变化可判断:
增大
D . 根据溶液pH和导电能力的变化可判断: 
有下列物质:①CuSO4·5H2O ②KHSO4 ③液态HCl ④稀硫酸 ⑤二氧化碳 ⑥铜 ⑦蔗糖 ⑧熔融氯化钠。请回答下列问题:
-
(1) 可以导电的有(填序号)。
-
(2) 属于电解质的有(填序号)。
-
(3) 属于非电解质的有(填序号)。
-
(4) ②在水中的电离方程式为。
常温下,下列有关电解质溶液的说法错误的是( )
A . 相同浓度、相同体积的 CH3COONa和NaBr两溶液,前者的离子总数小
B . pH=11的氨水和pH=3的盐酸等体积混合后c(NH  )+c(OH-)<c(Cl-)+c(H+)
C . 相同浓度、相同体积H2C2O4-NaHC2O4混合溶液c(H+)+c(H2C2O4) = c(Na+)+c(C2O
)+c(OH-)<c(Cl-)+c(H+)
C . 相同浓度、相同体积H2C2O4-NaHC2O4混合溶液c(H+)+c(H2C2O4) = c(Na+)+c(C2O  )+c(OH-)
D . 在1mol·L-1Na2SO3 溶液中,c(SO
)+c(OH-)
D . 在1mol·L-1Na2SO3 溶液中,c(SO  )+c(HSO
)+c(HSO  )+c(H2SO3) = 1mol·L-1
)+c(H2SO3) = 1mol·L-1
 )+c(OH-)<c(Cl-)+c(H+)
C . 相同浓度、相同体积H2C2O4-NaHC2O4混合溶液c(H+)+c(H2C2O4) = c(Na+)+c(C2O
)+c(OH-)<c(Cl-)+c(H+)
C . 相同浓度、相同体积H2C2O4-NaHC2O4混合溶液c(H+)+c(H2C2O4) = c(Na+)+c(C2O  )+c(OH-)
D . 在1mol·L-1Na2SO3 溶液中,c(SO
)+c(OH-)
D . 在1mol·L-1Na2SO3 溶液中,c(SO  )+c(HSO
)+c(HSO  )+c(H2SO3) = 1mol·L-1
)+c(H2SO3) = 1mol·L-1
下列物质的水溶液因电离而呈酸性的是( )
A . CaCl2
B . NaHSO4
C . CH3COONa
D . NH4Cl
-
(1) I.实验室用
 标准溶液滴定未知浓度的盐酸。
标准溶液滴定未知浓度的盐酸。 
盛NaOH标准液的滴定管尖嘴部分留有气泡,排除气泡的方法应采用图1中的操作。(填“甲”、“乙”、“丙”)
-
(2) 选择酚酞作为指示剂,滴定终点的现象为。
-
(3) 下列操作会导致实验结果偏低的是_________。(填标号)A . 碱式滴定管未用标准NaOH溶液润洗 B . 盛装未知液的锥形瓶用蒸馏水洗过后再用未知液润洗 C . 滴定终点读数时,仰视滴定管的刻度 D . 滴定过程中振荡锥形瓶,液体不慎溅出
-
(4) 某学生进行3次实验得到相关数据如表所示。
滴定次数
待测盐酸的体积/mL
消耗
 溶液的体积/mL
溶液的体积/mL滴定前读数
滴定后读数
第一次
25.00
0.00
26.11
第二次
25.00
1.56
30.30
第三次
25.00
0.22
26.31
则盐酸的物质的量浓度为
 。(保留三位小数)
。(保留三位小数) -
(5) II.一定浓度的H2SO4溶液中所含硫元素所有微粒的物质的量分数随pH的变化如图2所示。

NaHSO4在水中电离方程式为。
-
(6) 图中a、b、c三点,水电离的
 由大到小的顺序分为。(用a、b、c表示)
由大到小的顺序分为。(用a、b、c表示)
-
(7) pH=3时,
 。
。
下列有关电解质溶液的说法正确的是( )
A . 将Ca(ClO)2、 Na2SO3、 FeCl3、 KAl (SO4)2的各自溶液分别蒸干均得不到原溶质
B . 配制Fe(NO3)2溶液时,向Fe(NO3)2溶液中滴加几滴稀硝酸,以防止Fe(NO3)2 发生水解
C . Ksp和溶解度都受温度的影响,常温下,AgCl 在NaCl溶液中的Ksp和溶解度与在纯水中的Ksp和溶解度相同
D . NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度不相同
下列溶液中因水的电离被促进而导致溶液呈酸性的是( )
A . NaHSO4溶液
B . Na2SO4溶液
C . KNO3溶液
D . KAl(SO4)2溶液
对于成千上万、形形色色的化学物质,用分类的思想对其进行学习和研究极其重要。有以下物质,请按要求作答。
① ②
②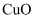 ③熔融
③熔融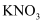 ④盐酸 ⑤葡萄糖溶液⑥
④盐酸 ⑤葡萄糖溶液⑥ ⑦
⑦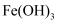 胶体 ⑧
胶体 ⑧ ⑨细铁丝 ⑩
⑨细铁丝 ⑩
-
(1) 上述物质能导电的有(填序号,下同),属于电解质的有。
-
(2) 请写出②与④反应的化学方程式。
-
(3) 胶体是一类重要的分散系,请写出实验室制备⑦的化学方程。
-
(4) 向⑩的水溶液中逐滴滴加⑧的水溶液,溶液的导电能力变化曲线如图中的(填字母),当溶液恰好呈中性时
 与
与 的物质的量之比为。
的物质的量之比为。
25℃时有以下 5 种溶液:①0.10mol/LHCl 溶液②0.10mol/LCH3COOH 溶液③0.10mol/LNaOH 溶液④0.10mol/LNH4Cl 溶液⑤饱和 FeCl3 溶液。
-
(1) 溶液①的 pH7(填“>”、“<”或者“=”)。
-
(2) 写出 CH3COOH 的电离方程式。
-
(3) 将②与③等体积混合后,溶液中存在的离子浓度由大到小的顺序是
-
(4) 用广泛pH 试纸测得④的 pH=5,请结合化学用语对 NH4Cl 溶液显酸性的原因进行完整说明。
-
(5) 加热⑤可制备 Fe(OH)3 胶体,请结合化学用语解释。
从铜电解液中分离得到的粗硫酸镍晶体中含有大量的杂质元素(Cu、Fe、As、Ca、Zn等),我国科学家对粗硫酸镍进行精制提纯,其工艺流程如下。

已知:i.含镍溶液中的主要离子有:Ni2+、SO 、Cu2+、Fe2+、AsO
、Cu2+、Fe2+、AsO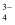 、Ca2+和Zn2+
、Ca2+和Zn2+
ii.饱和H2S溶液中,c(H2S)≈0.1mol/L
ⅲ.部分物质的电离常数和溶度积常数如下表
物质 | 电离常数 | 物质 | 溶度积常数 | 物质 | 溶度积常数 |
H2S | Ka1=1.1×10−7 Ka2=1.3×10−13 | CuS | 6.3×10−36 | FeS | 6.3×10−18 |
NiS | 3.2×10−19 | Ni(OH)2 | 5.5×10−16 | ||
CaF2 | 4×10−11 | Fe(OH)3 | 2.8×10−39 |
-
(1) H2S是弱电解质,Ka1×Ka2=[用c(H2S)、c(H+)和c(S2−)表示]=1.43×10−20。
-
(2) 滤渣1中含有As2S3和S,写出生成As2S3和S的离子方程式。
-
(3) 解释“氧化除杂”中析出Fe(OH)3的原因。
-
(4) “氟化除杂”中试剂a为。
-
(5) “P204萃取”水溶液的pH约为3.3,结合下图解释原因。

-
(6) 理论上“硫化除杂”之后,溶液中c(Cu2+)=mol/L[计算时c(H2S)取0.1mol/L,结果保留两位有效数字]。
25℃时,0.100mol/L二元弱酸 (或其钠盐)用相同浓度的NaOH溶液(或盐酸)滴定,其pH与滴定分数
(或其钠盐)用相同浓度的NaOH溶液(或盐酸)滴定,其pH与滴定分数 (
( 或
或 )的关系如下图所示,下列说法正确的是( )
)的关系如下图所示,下列说法正确的是( )
 (或其钠盐)用相同浓度的NaOH溶液(或盐酸)滴定,其pH与滴定分数
(或其钠盐)用相同浓度的NaOH溶液(或盐酸)滴定,其pH与滴定分数 (
( 或
或 )的关系如下图所示,下列说法正确的是( )
)的关系如下图所示,下列说法正确的是( )

A . 曲线①表示盐酸滴定 溶液
B . 25℃时,
溶液
B . 25℃时, C . 溶液中:a点
C . 溶液中:a点 比b点
比b点 大
D . c点溶液中:
大
D . c点溶液中:
 溶液
B . 25℃时,
溶液
B . 25℃时, C . 溶液中:a点
C . 溶液中:a点 比b点
比b点 大
D . c点溶液中:
大
D . c点溶液中:
最近更新



