原子中的数量关系 知识点题库
在离子 RO3n-中, 共有x个核外电子,R 原子的质量数为 A , 则R原子核内含有的中子数目是( )
A . A-x+n+48
B . A-x+n+24
C . A-x-n-24
D . A+x-n-24
下列说法正确的是( )
A . H2O和H2O2中的化学键类型完全相同
B . N2的结构式为N﹣N
C . 一个D216O分子所含的中子数为10
D . NaCl的电子式为 
某元素的一种同位素X的原子质量数为A,含N个中子,它与11H原子组成HmX分子.在a 克HmX中所含质子的物质的量是( )
A . 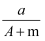 (A﹣N+m) mol
B .
(A﹣N+m) mol
B .  (A一N) mol
C .
(A一N) mol
C . 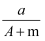 (A﹣N) mol
D .
(A﹣N) mol
D .  (A一N+m) mol
(A一N+m) mol
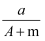 (A﹣N+m) mol
B .
(A﹣N+m) mol
B .  (A一N) mol
C .
(A一N) mol
C . 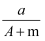 (A﹣N) mol
D .
(A﹣N) mol
D .  (A一N+m) mol
(A一N+m) mol
具有9个质子和10个电子的微粒是( )
A . Na+
B . O2﹣
C . F﹣
D . Ne
136C﹣NMR(核磁共振)可用于含碳化合物的结构分析,136C表示的含义正确的是( )
A . 质量数是13,原子序数是6,核内有6个中子
B . 与金刚石、石墨、C60等互为同素异形体
C . 碳元素的相对原子质量为13
D . 碳的一种核素,与126C互为同位素
法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也 有人称之为“零号元素”.下列有关“四中子”粒子的说法不正确的是( )
A . 该粒子不显电性
B . 与氢元素的质子数相同
C . 该粒子质量数为4
D . 该粒子质量比氢原子大
氯的原子序数为17,35Cl是氯的一种同位素,下列说法正确的是( )
A . 35Cl原子所含质子数为18
B . 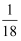 mol的1H35Cl分子所含中子数约为6.02×1023
C . 3.5g的35Cl2气体的体积为1.12L
D . 35Cl2气体的摩尔质量为70
mol的1H35Cl分子所含中子数约为6.02×1023
C . 3.5g的35Cl2气体的体积为1.12L
D . 35Cl2气体的摩尔质量为70
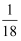 mol的1H35Cl分子所含中子数约为6.02×1023
C . 3.5g的35Cl2气体的体积为1.12L
D . 35Cl2气体的摩尔质量为70
mol的1H35Cl分子所含中子数约为6.02×1023
C . 3.5g的35Cl2气体的体积为1.12L
D . 35Cl2气体的摩尔质量为70
根据问题填空:
-
(1) 下列原子:
 C、147N、
C、147N、  Na、
Na、  H、
H、  U、
U、  K、
K、 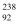 U中共有种元素,种核素,和互为同位素.
U中共有种元素,种核素,和互为同位素.
-
(2) 下列曲线分别表示元素的某种性质与核电荷数的关系(X为核电荷数,Y为元素的 有关性质).把与下面元素有关的性质相符的曲线标号填入相应的空格中:

② 第ⅡA族元素的最外层电子数;
②第三周期元素的最高化合价;
③碱金属单质的熔点
-
(3) 阴离子的中子数为N:AXn﹣共有x个电子,则N=.
-
(4) 有下列物质中NH3、Na2O、CO2、CaCl2、CCl4、N2、NaHCO3、NaOH、Na2O2、NH4Cl属于电解质的有.
根据题意进行填空:
-
(1) 核外电子层结构相同的一组粒子是
A.Mg2+、Al3+、Cl﹣、Ne B.Na+、F﹣、S2﹣、Ar
C.K+、Ca2+、S2﹣、Ar D.Mg2+、Na+、Cl﹣、S2﹣
其离子半径大小关系为(由大到小排列),
-
(2) 将下列粒子的符号填入相应的空格内:O2、NH3、H2O2、(NH4)2SO4、NaCl.
①存在非极性键的分子是.
②存在极性键的分子是.
③存在极性共价键的离子化合物是.
美国科学家合成了含有  的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如下图所示(图中箭头代表单键)。以下有关该物质的说法中正确的是( )
的盐类,含有该离子的盐是高能爆炸物质,该离子的结构呈“V”形,如下图所示(图中箭头代表单键)。以下有关该物质的说法中正确的是( )

A . 每个  中含有35个质子和36个电子
B . 该离子中只含有非极性键
C . 该离子中含有2个π键
D .
中含有35个质子和36个电子
B . 该离子中只含有非极性键
C . 该离子中含有2个π键
D .  与P
与P  互为等电子体
互为等电子体
 中含有35个质子和36个电子
B . 该离子中只含有非极性键
C . 该离子中含有2个π键
D .
中含有35个质子和36个电子
B . 该离子中只含有非极性键
C . 该离子中含有2个π键
D .  与P
与P  互为等电子体
互为等电子体
和Na+ 离子都具有相同质子数和电子数的一组微粒是( )
A . CH4 NH4+
B . CH4 H2O
C . NH4+ H3O+
D . OH- NH3
补钙是人类保健的热点,人体需要摄入一定量钙元素。关于钙离子与钙原子的比较正确的是( )
A . 质量Ca2+比Ca大
B . 半径Ca2+比Ca大
C . 电子Ca2+比Ca少
D . 质子Ca2+比Ca少
硒(Se)元素是人体必需的微量元素。Se具有抗癌作用,其原子核内的中子数是()
A . 11
B . 34
C . 45
D . 79
某元素二价阳离子的核外有18个电子,质量数为40,该元素的原子核中的中子数为 ( )
A . 16
B . 18
C . 20
D . 22
下列说法正确的是( )
A . 同一元素各核素的质量数不同,所以它们的化学性质不相同
B . 任何元素的原子都是由核外电子和核内质子、中子组成
C .  、
、  与
与  的质量数相同,质子数和中子数不同。
D . H,D,T互称为核素
的质量数相同,质子数和中子数不同。
D . H,D,T互称为核素
 、
、  与
与  的质量数相同,质子数和中子数不同。
D . H,D,T互称为核素
的质量数相同,质子数和中子数不同。
D . H,D,T互称为核素
下列有关化学用语正确的是( )
A . 中子数为10的氧原子:  B . 中子数为18的氯离子的结构示意图为:
B . 中子数为18的氯离子的结构示意图为:  C . 肼(N2H4)的电子式为:
C . 肼(N2H4)的电子式为: 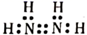 D . 甲酸乙酯的结构简式为:CH3COOCH2CH3
D . 甲酸乙酯的结构简式为:CH3COOCH2CH3
 B . 中子数为18的氯离子的结构示意图为:
B . 中子数为18的氯离子的结构示意图为:  C . 肼(N2H4)的电子式为:
C . 肼(N2H4)的电子式为:
元素R的质量数为A,Rn一的核外电子数为x,则WgRn一所含中子的物质的量为( )
A . (A-x+n)mol
B . (A-x-n)mol
C .  mol
D .
mol
D .  mol
mol
 mol
D .
mol
D .  mol
mol
关于氘原子( 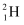 )说法错误的是( )
)说法错误的是( )
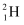 )说法错误的是( )
)说法错误的是( )
A . 电子数为1
B . 中子数为2
C . 质量数为2
D . 质子数为1
2020年初,中国武汉爆发新冠肺炎,用13C—NMR(核磁共振)、15N—NMR可用于测定核酸等生物大分子的空间结构从而快速确诊,下列有关13C、15N的叙述正确的是( )
A . 13C、15N具有相同的中子数
B . 13C与12C60是两种不同的核素
C . 15N的核外电子数与中子数相同
D . 15N与14N化学性质相同
化学符号是我们的化学语言,下列有关化学用语使用正确的是( )
A . MgCl2的形成过程可表示为 B . 中子数比质子多3的氯原子:20Cl
C . HClO的结构式:H-O-Cl
D . Na2S的电子式为
B . 中子数比质子多3的氯原子:20Cl
C . HClO的结构式:H-O-Cl
D . Na2S的电子式为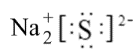
最近更新



