原子核外电子排布 知识点题库
北京大学和中国科学院的化学工作者已成功研制出碱金属与C60形成的球碳盐K3C60 , 实验测知该物质熔融状态下能导电.下列有关分析正确的是( )
A . K3C60和C60中都含有共价键
B . 钾的核外电子排布为:1s22s22p63s23p63d104s1
C . K3C60和C60都属于分子晶体,具有较低的熔点
D . C60与12C互为同素异形体
下列各微粒中,核外电子总数相等的是( )
A . CO2 和 NO2
B . H2S 和 H2O
C . NH4+ 和 H2O
D . N2 和 C2H4
下列各基态原子或离子的电子排布式正确的是( )
A . O2﹣1s22s22p4
B . Ca 3d2
C . Fe 3d54s3
D . Si 1s22s22p63s23p2
已知某元素+2价离子的电子排布式为1s22s22p63s23p6,该元素在周期表中位于( )
A . 第ⅤB族
B . 第ⅡB族
C . 第Ⅷ族
D . 第ⅡA族
下列原子的电子排布图中,正确的是( )
A .  B .
B .  C .
C .  D .
D . 
 B .
B .  C .
C .  D .
D . 
碳、氮、氧、磷、硫、铁,锌、铜等都是组成蛋白质的重要元素。回答下列问题:
-
(1) Fe的基态原子的核外电子排布式为,3d能级上的未成对电子数为。
-
(2) 在C、N、O、P、S五种元素中,第一电离能最大的元素是(填元素符号,下同),电负性最大的元素是
-
(3) 氨基乙酸(H2NCH2COOH)是蛋白质完全水解的产物之一,其中C原子的杂化轨道类型为;1molH2NCH2COOH中含有
 键的数目为NA。
键的数目为NA。
-
(4) 蛋白质在体内部分被氧化生成尿素[CO(NH2)2]、二氧化碳、水等排出体外。
①CO2、H2O分子的空间构型分别为、。
②尿素的熔点为132.7℃,其固体属于晶体。
③尿素易溶于水,其原因除都是极性分子外,还有。
-
(5) Cu与H元素形成某种晶体的结构如图所示,则该晶体的化学式为。若该晶体的密度为ρg·cm-3 , 阿伏加德罗常数的值为NA , 则该晶胞的棱长为nm(用含ρ和NA的式子表示)

铜是人类最早发现并广泛使用的一种金属。向硫酸铜溶液中逐滴滴加稀氨水,产生蓝色沉淀:继续滴加稀氨水,沉淀溶解,溶液最终变为深蓝色:再向深蓝色溶液中加入无水乙醇,析出[Cu(NH3)4]SO4·H2O。回答下列问题:
-
(1) 基态Cu原子中,电子在核外排布的原子轨道共有个。
-
(2) N、O、S元素的原子对键合电子吸引力最大的是。
-
(3) [Cu(NH3)4]2+中,提供孤对电子的是。Cu(NH3)2Cl2有两种同分异构体,其中一种可溶于水,则此种化合物是(填“极性”或“非极性”)分子,由此推知[Cu(NH3)4]2+的空间构型是。
-
(4) NH3中N原子的杂化方式是,乙醇分子中采用同样杂化方式的原子有个。
-
(5) 硫元素对应的含氧酸酸性是H2SO4强于H2SO3 , 其原因为。
-
(6) 铜的一种氧化物晶体结构如图所示,该氧化物的化学式是。若该晶体结构为长方体,其参数如图,阿伏加德罗常数为NA , 则该氧化物的密度为g·cm-3。

下列具有相同电子层数的一组原子是( )
A . H、He、Li
B . Li、Na、K
C . Na、Si、Ar
D . O、S、Cl
祖母绿被称为绿宝石之王,是国际珠宝世界公认的四大名贵宝石之一,其化学式为Be3Al2Si6O18。回答下列问题:
-
(1) 基态Be原子的电子排布图为,基态Al原子核外电子占据个轨道,其中能量最高能级的原子轨道的形状为。
-
(2) Al、Si、O的第一电离能由大到小的排序为。
-
(3) SO3分子中硫原子的杂化类型是,SO3分子的空间构型是。
-
(4) 工业上,电解制取金属铝,不能用熔融的AlCl3 , AlCl3的晶体类型是,将Be3Al2Si6O18写为氧化物的式子是。
-
(5) LiAlH4在有机合成中可将羧基还原成羟基。甲酸和乙醇的熔、沸点如图所示:

1mol甲酸分子中σ键与π键的比值为,甲酸和乙醇的熔点相差较大的主要原因是。

-
(6) 碳化硅的晶体类型类似金刚石,晶胞结构如图所示。已知:碳化硅的晶体密度为ag/cm3 , NA代表阿伏加德罗常数的数值。该晶胞边长为pm。
某原子核外电子排布为ns2np7 , 它违背了( )
A . 能量最低原理
B . 泡利不相容原理
C . 洪特规则
D . 洪特规则特例
下列关于物质的组成、结构或性质的叙述中,正确的是( )
①HF的稳定性很强,是因为其分子间能形成氢键
②基态原子价电子排布式为(n-1)d6~8ns2的元素属于第ⅧB族
③能层为1时,有自旋方向相反的两个轨道
④“量子化”就是连续的意思,微观粒子运动均有此特点
⑤前四周期元素中,基态原子中未成对电子与其所在周期数相同的元素有5种
⑥次氯酸分子的电子式: ![]()
⑦氯离子与硫离子的核外电子排布相同,都是1s22s22p63s23p6 , 两粒子的3p能级上的电子离核的距离相同
⑧S2-、Cl-、K+、Na+半径逐渐减小
⑨最外层有3个未成对电子的原子一定属于主族元素
A . ①③④⑦⑧
B . ⑤⑧⑨
C . ②③⑤⑥⑦⑨
D . ②⑦⑧⑨
A、B、C、D、E代表原子序数依次增大的5种元素,均位于周期表前四周期。请填空:
-
(1) A元素基态原子的价电子排布式为
 ,原子序数,基态原子核外电子排布式为:。能量最高的电子所处原子轨道的形状为形。
,原子序数,基态原子核外电子排布式为:。能量最高的电子所处原子轨道的形状为形。
-
(2) C元素的为最活泼的非金属元素,C的元素符号为,B的价电子排布图为。
-
(3) D的基态原子所具有的单电子数是前四周期基态原子中单电子数目最多的元素,D的元素符号为,其基态原子的电子排布式为。
-
(4) E元素基态原子的M层全充满,与A位于同一主族,其某种氧化物有剧毒。E元素的名称,原子结构示意图为。
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子最外层电子数是其电子层数的2倍,X、Y价电子数之比为2∶3。W的原子半径在同周期主族元素中最小,金属单质Z在空气中燃烧生成的化合物可用作呼吸面具的供氧剂。下列说法错误的是( )
A . 原子半径X>Y,离子半径Z>Y
B . 化合物Z2Y存在离子键,ZWY中既有存在离子键又有共价键
C . X的简单氢化物与W的单质在光照下产生W的氢化物
D . Y、W的某些单质或两元素之间形成的某些化合物可作水的消毒剂
A、B、C、D、E为原子序数依次增大的五种短周期主族元素,其中仅含有一种金属元素,A单质是自然界中密度最小的气体,A和D最外层电子数相同;B和C在周期表中相邻,C和E同主族。B、C的最外层电子数之和等于D的原子核外电子数,D和C可形成D2C和D2C2两种常见的离子化合物。请回答下列问题:
-
(1) D2C2的化学名称是,E的简单阴离子结构示意图。
-
(2) C,D,E三种元素简单离子的离子半径由大到小的顺序是__(用离子符号填写)。
-
(3) 写出D的最高价氧化物的水化物与E的最高价氧化物的水化物反应生成酸式盐的化学方程式:。
-
(4) 用含A元素最简单的有机化合物与炽热的氧化铜反应生成一种单质、液态氧化物和一种可以使澄清石灰水变浑浊的气体,其化学方程式为。
-
(5) 化合物DA与化合物A2C之间 (填“可能”或“不可能)发生反应产生H2 , 判断理由是。
如图是s能级和p能级的原子轨道图,下列说法正确的是( )


A . s能级和p能级的原子轨道形状相同
B . 每个p能级都有6个原子轨道
C . 钠原子的核外电子在11个原子轨道上高速运动
D . s能级的原子轨道半径与电子层数有关
原子序数小于36的某基态原子最外层电子排布式为ns1 , 则该基态原子在元素周期表中不可能位于( )
A . 第ⅠA族
B . 第B族
C . 第Ⅷ族
D . 第ⅠB族
下列各原子或离子的电子排布式错误的是( )
A . K+ 1s22s22p63s23p6
B . As 1s22s22p63s23p63d104s24p3
C . N3- 1s22s22p6
D . Cr 1s22s22p63s23p63d44s2
碘酸钾( )在化工、医药等领域有着广泛的应用。回答下列问题:
)在化工、医药等领域有着广泛的应用。回答下列问题:
 )在化工、医药等领域有着广泛的应用。回答下列问题:
)在化工、医药等领域有着广泛的应用。回答下列问题:
-
(1) 基态I原子中,核外电子占据最高能层的符号是,能量最高的电子云轮廓图形状为。
-
(2) K和Cr同属第四周期元素,原子半径大小顺序为,铬元素的价电子数目为,钾的金属键(填“强于”或“弱于”)铬的金属键。
-
(3) 碘在水中的溶解度较小,是因为。
-
(4) K、I、O三种元素的电负性由大到小的顺序为。
-
(5)
 晶体是一种性能良好的光学材料,其晶胞结构如图所示,边长为a nm,则
晶体是一种性能良好的光学材料,其晶胞结构如图所示,边长为a nm,则 晶体的密度可表示为
晶体的密度可表示为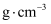 ;晶胞中相邻O原子间的最近距离为nm。
;晶胞中相邻O原子间的最近距离为nm。

不锈钢是由铁、铭、锦、碳及众多不同元素所组成的合金,回答下列相关问题:
-
(1) 基态碳原子的核外电子轨道表示式为。
-
(2)
 中Cr的配位数为。
中Cr的配位数为。
-
(3) 铁在元素周期表中的位置是,铁原子核外电子发生跃迁时会吸收或释放不同的光,可以用摄取铁元素的原子光谱。
-
(4) 与铁属于同一周期,且未成对价电子数最多的元素的是(填元素符号)。
-
(5) Fe、Sr、O可形成两种晶体,晶胞结构如图所示,已知NA为阿伏加德罗常数,图甲、图乙表示的晶胞均为立方晶胞。

①图甲晶胞化学式是。
②图乙所示晶胞密度为d g/cm3 , 则该晶胞的边长为nm(用含NA的式子表示)
以 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
 、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
、ZnO等半导体材料制作的传感器和芯片具有能耗低、效率高的优势。回答问题:
-
(1) 基态O原子的电子排布式,其中未成对电子有个。
-
(2) Cu、Zn等金属具有良好的导电性,从金属键的理论看,原因是。
-
(3) 酞菁的铜、锌配合物在光电传感器方面有着重要的应用价值。酞菁分子结构如下图,分子中所有原子共平面,所有N原子的杂化轨道类型相同,均采取杂化。邻苯二甲酸酐(
 )和邻苯二甲酰亚胺(
)和邻苯二甲酰亚胺(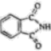 )都是合成菁的原料,后者熔点高于前者,主要原因是。
)都是合成菁的原料,后者熔点高于前者,主要原因是。
-
(4) 金属Zn能溶于氨水,生成以氨为配体,配位数为4的配离子,Zn与氨水反应的离子方程式为。
-
(5) ZnO晶体中部分O原子被N原子替代后可以改善半导体的性能,Zn-N键中离子键成分的百分数小于Zn-O键,原因是。
-
(6) 下图为某ZnO晶胞示意图,下图是若干晶胞无隙并置而成的底面O原子排列局部平面图。
 为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
为所取晶胞的下底面,为锐角等于60°的菱形,以此为参考,用给出的字母表示出与所取晶胞相邻的两个晶胞的底面、。
最近更新



