相对原子质量及其计算 知识点题库
某气体物质的质量为32g,含有6.02×1023个分子,则该气体的相对分子质量是( )
A . 64
B . 32
C . 96
D . 124
在国际相对原子质量表上查得碳的相对原子质量是12.01,这里的12.01是指( )
A . 碳元素的平均相对原子质量
B . 碳原子质量
C . 同位素C﹣12的行相原子质量
D . C﹣12的质量数
氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23%=35.453中( )
A . 75.77%表示35Cl的质量分数
B . 35.5表示氯元素的近似相对原子质量
C . 24.23%表示35Cl的丰度
D . 36.966表示37Cl的质量数
铜元素有质量数为63和65的两种天然同位素,它的近似相对原子质量是63.5,则同位素63Cu所占的质量百分比为( )
A . 20%
B . 25%
C . 74.4%
D . 75%
硼有两种同位素10B和11B,硼元素的近似相对原子质量为10.8,则10B的质量分数为
某短周期元素X的气态氢化物化学式为HnX.在标准状况下,8.5g HnX气体的体积是5.6L. 17g HnX气体与200ml 5mol/L的NaOH溶液恰好完全反应.
(1)求X的相对原子质量.
(2)写出HnX的化学式,并用电子式表示它的形成过程.
2.8g某单质A能从盐酸中置换出0.1g H2 , 同时生成ACl2;另一元素B,它的最高价氧化物的化学式为BO3 . 在B的氢化物中,B的质量分数为94.1%.计算A、B两种元素的相对原子质量.
已知一个12C原子的质量是mg,元素R的某种原子的一个原子的质量为ng,元素R的这种原子的相对原子质量为( )
A . n
B .  C .
C . 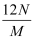 D . n×NA
D . n×NA
 C .
C . 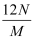 D . n×NA
D . n×NA
居里夫人为了纪念自己的祖国,把她发现的元素命名为钋、镭,其中钋(84Po)元素的一种同位素的中子数是质子数的1.49倍.该原子的质量数为( )
A . 84
B . 125
C . 209.16
D . 209
某元素由2种同位素组成,其原子比为5:2,第一种同位素的二价阳离子有27个电子,34个中子;第二种同位素原子的中子数比第一种多2个,该元素的平均近似相对原子质量为( )
A . 63.47
B . 64.47
C . 63.57
D . 64.57
氯元素在自然界有35Cl和37Cl两种同位素,在计算式34.969×75.77%+36.966×24.23%=35.453中( )
A . 75.77%表示35Cl的质量分数
B . 24.23%表示35Cl的丰度
C . 35.453表示氯元素的相对原子质量
D . 36.966表示37Cl的质量数
还原某二价金属的氧化物4克,需0.2mol电子,则该金属元素的相对原子质量为( )
A . 24
B . 40
C . 56
D . 64
利用下图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。
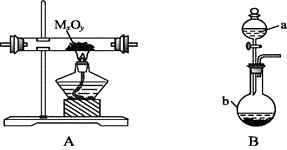

-
(1) 仪器a的名称为,仪器b中装入的试剂可以是。
-
(2) 按气流方向正确的装置连接顺序为(填序号,装置可重复使用):。
-
(3) 装置C的作用:。
-
(4) 实验结束时,应首先(填序号); 这样做的原因是。
Ⅰ.熄灭A装置的酒精灯 Ⅱ.停止从a中滴加液体
-
(5) 若金属氧化物为CuO,反应的化学方程式为。
-
(6) 若实验中准确称取金属氧化物的质量为mg,完全反应后,测得生成水的质量为ng,则M的相对原子质量为(用含x、y、m、n的式子表示)。
-
(7) 某同学仔细分析上述装置后认为仍存在缺陷,你认为该如何改进?。
在120℃、101kPa条件下,由H2、CH4组成的混合气体amL,通入一定量(设为xmL)氧气使其完全燃烧。
-
(1) 若amL混合气体完全燃烧消耗相同条件下氧气的体积也为amL(即x=a),则原混合气体中CH4的体积分数是(保留三位有效数字);
-
(2) 若原混合气体完全燃烧时,生成的气体中只有CO2和H2O(g),则x的取值范围是。
某学习小组用图示装置测定铝镁合金中铝的质量分数和铝的相对原子质量。
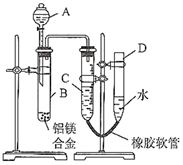
-
(1) A中试剂为
-
(2) 实验前,先将铝镁合金在稀酸中浸泡片刻,其目的是
-
(3) 检查气密性,将药品和水装入各仪器中,连接好装置后,需进行的操作还有:①记录C的液面位置;②将B中剩余固体过滤,洗涤,干燥,称重;③待B中不再有气体产生并恢复至室温后,记录C的液面位置;④由A向B滴加足量试剂。上述操作的顺序是(填序号)。
-
(4) B中发生反应的化学方程式为
-
(5) 若实验用铝镁合金的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为。
下列叙述正确的是( )
A . KOH的质量是56g
B . 一个碳原子的质量就是其相对原子质量
C . 氧原子的摩尔质量就是氧的相对原子质量
D . 32g SO2中含有的氧原子的物质的量为1mol
某氯原子的质量为ag,12C原子的质量为bg,用NA表示阿伏加德罗常数。下列说法正确的是( )
A . 该氯原子的相对原子质量是12a/bg/mol
B . 该氯原子的摩尔质量是aNA g
C . Wg该氯原子的物质的量一定是  mol
D . Wg该氯原子所含的电子个数为
mol
D . Wg该氯原子所含的电子个数为 
 mol
D . Wg该氯原子所含的电子个数为
mol
D . Wg该氯原子所含的电子个数为 
某元素的核素 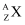 ,其氯化物XCl2 111mg溶于水后,加入0.1mol/L的硝酸银溶液20mL,恰好将其中的Cl-完全沉淀。已知该核素中的质子数和中子数相等。试回答下列问题:
,其氯化物XCl2 111mg溶于水后,加入0.1mol/L的硝酸银溶液20mL,恰好将其中的Cl-完全沉淀。已知该核素中的质子数和中子数相等。试回答下列问题:
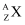 ,其氯化物XCl2 111mg溶于水后,加入0.1mol/L的硝酸银溶液20mL,恰好将其中的Cl-完全沉淀。已知该核素中的质子数和中子数相等。试回答下列问题:
,其氯化物XCl2 111mg溶于水后,加入0.1mol/L的硝酸银溶液20mL,恰好将其中的Cl-完全沉淀。已知该核素中的质子数和中子数相等。试回答下列问题:
-
(1) X元素的原子序数为,原子结构示意图为;
-
(2) 用电子式表示出XCl2的形成过程;
-
(3) 写出元素X的氢化物的电子式;将其氢化物放入水中,立刻剧烈反应,向反应后的水溶液中滴加酚酞试剂,溶液变红色,写出该反应的化学方程式。
下列有关叙述中错误的是( )
A . S2-的结构示意图: 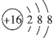 B . 原子核内有18个中子的氯原子:
B . 原子核内有18个中子的氯原子:  C . Na2O2中氧元素的化合价为-1
D . 元素周期表中铋元素的数据见下图,其中209.0指的是Bi 元素的质量数
C . Na2O2中氧元素的化合价为-1
D . 元素周期表中铋元素的数据见下图,其中209.0指的是Bi 元素的质量数
 C . Na2O2中氧元素的化合价为-1
D . 元素周期表中铋元素的数据见下图,其中209.0指的是Bi 元素的质量数
C . Na2O2中氧元素的化合价为-1
D . 元素周期表中铋元素的数据见下图,其中209.0指的是Bi 元素的质量数 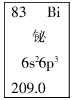
H2O是地球上分布最广泛的物质。H2O的摩尔质量为( )
A . 10
B . 18
C . 10g·mol-1
D . 18g·mol-1
最近更新



