相对原子质量及其计算 知识点题库
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4 , 不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.K3[Fe(CN)6]溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4可转化为FeCO3 , FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s)  H =-1648kJ/mol
H =-1648kJ/mol
C(s)+O2(g)=CO2(g)  H =-393kJ/mol
H =-393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)  H =-1480kJ/mol
H =-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(5)FeSO4在一定条件 下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电 时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(6)假 如烧渣中的铁全部视为Fe2O3 , 其含量为 50%。将a kg质量分数为b%的硫酸加入到c kg烧渣中浸取, 铁的浸取率为96%,其他杂质浸出消耗的硫酸以 及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
①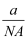 ②
② ③aNA ④
③aNA ④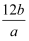 数,则下列各式中能表示该原子的相对原子质量数值的是( )
数,则下列各式中能表示该原子的相对原子质量数值的是( )
 和
和  两各稳定同位素,它们在氯气中的原子数之比
两各稳定同位素,它们在氯气中的原子数之比  :
:  为3:1.则相对分子质量为70、72、74、的氯气分子数之比可能是( )
为3:1.则相对分子质量为70、72、74、的氯气分子数之比可能是( )
 表示一种X元素的一种原子,中子数为A-Z
C .
表示一种X元素的一种原子,中子数为A-Z
C .  中,A为该原子的相对原子质量的近似值
D . 原子都是质子和中子、电子组成,原子不带电
中,A为该原子的相对原子质量的近似值
D . 原子都是质子和中子、电子组成,原子不带电

请回答下列问题:
-
(1) 氨气还原炽热氧化铜的化学方程式为。
-
(2) 从所提供的仪器及试剂中选择并组装本实验的一套合理、简单的装置,按气流方向的连接顺序为(用图中标注的字母表示)A→。
-
(3) 在本实验中,使测定结果Ar(Cu)偏大的是(填序号)。
①CuO未完全反应 ②CuO不干燥
③CuO中混有不反应的杂质 ④NH4Cl与Ca(OH)2混合物不干燥
 B . 该氖原子的摩尔质量是aNAg
C . Wg该氖原子的物质的量一定是
B . 该氖原子的摩尔质量是aNAg
C . Wg该氖原子的物质的量一定是  mol
D . Wg该氖原子所含质子数是
mol
D . Wg该氖原子所含质子数是 
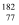 Ir的说法错误的是( )
Ir的说法错误的是( )
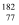 Ir和
Ir和  Ir互为同位素
Ir互为同位素
 B . 该镁原子的摩尔质量是aNAg/mol
C . Wg该镁原子的物质的量是
B . 该镁原子的摩尔质量是aNAg/mol
C . Wg该镁原子的物质的量是  mol
D . Wg该镁原子所含质子数是
mol
D . Wg该镁原子所含质子数是 
-
(1) 某种原子的质量是a g,若NA只表示阿伏加德罗常数的数值,该原子的相对原子质量为,b g该原子的物质的量为mol。
-
(2) a g A气体与b g B气体分子数相等,同温同压下,气体A与气体B的密度之比为。
-
(3) 向10 mL 0.1mol/LNaHCO3溶液中缓缓滴入0.1mol/LCa(OH)2溶液,首先发生反应的两种离子为(填离子符号,下同),随后溶液中有白色沉淀生成,生成沉淀的两种离子为。当加入少量Ca(OH)2溶液时,发生的离子反应方程式为。
-
(4) 将3.22 g芒硝(Na2SO4·10H2O)溶于水中,要使每100个水分子中溶有1个Na+ , 则需加入水的质量为g。

 C .
C .  D .
D . 
-
(1) B的相对原子质量是多少?原子序数是多少?
-
(2) A和C各是什么元素?
-
(3) A、B、C的单质各1 mol分别与足量的稀硫酸反应,产生H2最多的是哪一种单质?该单质产生H2的体积在标准状况下是多少?
-
(1) 该有机物的相对原子质量为(要求写出必要的计算过程)
-
(2) 该有机物分子中最多含有碳氧双键的个数为。
-
(1) 其中能导电的是;属于非电解质的是;
-
(2) 若④和⑤中所含氢原子数相等,则④和⑤的质量之比;
-
(3) 写出足量⑥和少量⑦在水溶液中反应的离子方程式;
-
(4) 室温下,某容积固定的密闭容器由可移动的活塞隔成A、B两室A室中充入H2、O2混合气体,B室充入1 mol空气,此时活塞的位置如图所示。
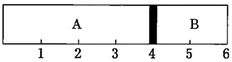
实验测得A室混合气体的质量为34 g,若将A室H2、O2的混合气体点燃,恢复原温度后,(非气体体积忽略不计)最终活塞停留的位置在刻度处。



