化学键 知识点题库
有关乙烷、乙烯、乙炔、苯分子结构的比较错误的是( )
A . 碳碳键长:乙烷>苯>乙烯>乙炔
B . 碳碳键键能:乙炔>乙烯>苯>乙烷
C . 键角:乙炔>乙烯═苯>乙烷
D . 乙烷、乙烯、乙炔、苯中各原子均处于同一平面上
下列变化中,不需要破坏化学键的是( )
A . 氯化氢溶于水
B . 加热氯酸钾使其分解
C . 碘升华
D . 氯化钠熔化
你认为下列对化学知识概括合理的组合是( )
①金属晶体中存在离子,但却不存在离子键
②原子晶体、离子晶体、金属晶体、分子晶体中都一定存在化学键
③原子晶体硬度一般比分子晶体大,分子晶体熔点不一定比金属晶体低
④固态能导电的一定是金属晶体
⑤NF3的沸点比NH3的沸点低是因为N﹣F比N﹣H键的键能小
⑥原子晶体一定由原子构成,由原子构成的晶体不一定是原子晶体
⑦共价化合物中可能含有离子键
⑧金属晶体中简单立方堆积的配位数是8,空间利用率最低.
A . 只有②③④
B . 只有②③⑦
C . 只有①③⑥
D . 只有⑤⑥⑧
下列过程中化学键发生断裂的是( )
①碘升华 ②溴蒸气被木炭吸附 ③酒精溶于水 ④HCl气体溶于水 ⑤MgCl2溶解于水 ⑥NaCl熔化.
A . 全部
B . ②③④⑤⑥
C . ④⑤⑥
D . ⑤⑥
关于化学键的下列叙述中,下列叙述不正确的是( )
A . 离子化合物可能含共价键
B . 共价化合物可能含离子键
C . 离子化合物中必含离子键
D . 共价化合物中不含离子键
下列各组物质气化或熔化时,所克服的微粒间的作用力,属同种类型的是( )
A . 碘和干冰的升华
B . 二氧化硅和生石灰的熔化
C . 氯化钠和铁的熔化
D . 干冰和氯化铵变成气体
原子间叫做共价键.成键微粒是,由形成的化合物叫共价化合物.共价化合物一般包括非金属氢化物如,非金属氧化物如,含氧酸如,个别盐如AlCl 3和大部分有机化合物如乙醇等.
2010年诺贝尔物理学奖所指向的是碳的又一张奇妙脸孔:人类已知的最薄材料——石墨烯。下列说法中,正确的是( )
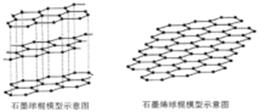
A . 固态时,碳的各种单质的晶体类型相同
B . 石墨烯含有极性键
C . 从石墨剥离得石墨烯需要破坏化学键
D . 石墨烯具有导电性
下列说法正确的是( )
A . 金刚石和足球烯(C60)均为原子晶体
B . NH4Cl属于离子化合物,该物质中只存在离子键
C . 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成
D . 干冰的升华,只需克服分子间作用力
下列物质中,只含有离子键,不含有共价键的是( )
A . CaCl2
B . NH4Cl
C . KOH
D . CO2
下列说法正确的是( )
A . 氯化钠熔化时克服离子键,碘升华克服共价键
B . HF 分子很稳定是由于 HF 分子之间能形成氢键
C . 可以用元素分析仪区别乙醇和二甲醚
D . 分子式为 C5H12O 且能与钠反应的有机物有 8 种
物质的结构决定其性质,元素周期表和元素周期律揭示了化学元素间的内在联系,使其构成了一个完整的体系。回答下列问题:
-
(1) 在硼、氮、氧、氟中,第一电离能由大到小排序为(用元素符号表示,下同)。四种元素中的基态原子中,未成对电子数最多的是。
-
(2) 已知硼酸的电离方程式为H3BO3+H2O
 [B(OH)4]+H+。
[B(OH)4]+H+。 ①硼酸是元酸。
②[B(OH)4]-中含有的化学键类型有(填标号)。
a.σ键 b.π键 c.配位键 d.非极性键
③由[B(OH)4]-推出[Al(OH)4]-的结构式为。
-
(3) 氟化硝酰(NO2F)与NO3-的结构相似,则其分子的立体构型是,N原子的杂化轨道类型为。
-
(4) 已知单质硼晶体的熔点为1873℃,单质硼晶体是晶体。

-
(5) 磷化硼(BP)是一种超硬耐磨涂层材料,其立方晶胞如图所示。已知晶胞中B-P键键长均为anm,阿伏加德罗常数的值为NA , 则磷化硼晶体的密度为g·cm-3(列出计算式)。
原子序数由小到大排列的四种短周期元素 X、Y、Z、W,其中 X、Z、W 与氢元 素可组成 XH3、H2Z 和 HW 共价化合物;Y 与氧元素可组成 Y2O 和 Y2O2 离子化合物。
-
(1) 写出 Y2O2 的电子式:,其中含有的化学键是。
-
(2) Z 元素在周期表中的位置是。X 和 Z 形成的一种二元化合物具有温室效应,其相 对分子质量在 170~190 之间,且 Z 的质量分数约为 70%。该化合物的化学式为 。
-
(3) XH3、H2Z 和 HW 三种化合物,其中一种与另外两种都能反应的是 (填化学式)。
-
(4) 由 X、W 组成的化合物分子中,X、W 原子的最外层均达到 8 电子稳定结构,该化合物遇水可生成一种具有漂白性的化合物,试写出反应的化学方程式。
第三代太阳能电池就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
-
(1) 晶体硅中Si原子的杂化方式是,基态Ga原子核外电子排布式为。
-
(2) 向硫酸铜溶液中逐滴滴加浓氨水,先出现蓝色絮状沉淀,后沉淀逐渐溶解得到[Cu(NH3)4]SO4的深蓝色透明溶液。
①NH3极易溶于水,除因为NH3与H2O都是极性分子外,还因为。
②在[Cu(NH3)4]2+中Cu2+与NH3之间形成的化学键称为,提供孤电子对的成键原子是。
③[Cu(NH3)4]2+具有对称的空间构型,[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为。
-
(3) 某含铜化合物的晶胞如图所示,晶胞上下底面为正方形,侧面与底面垂直。则晶胞中每个Cu原子与个S原子相连,含铜化合物的化学式为。设NA为阿伏加德罗常数的值,则该晶胞的密度为g•cm‑3(用含a、b、NA的代数式表示)。
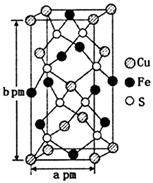
下列叙述中正确的是( )
A . 乙硫醇(CH3CH2SH)沸点大于乙醇(CH3CH2OH),因为前者相对分子质量大
B . [Cu(NH3)4]SO4·H2O中含离子键、极性共价键、配位键、分子间作用力
C . 原子的电子云轮廓图中小黑点表示核外电子运动过一次
D . 电负性越大的元素,第一电离能也越大
铁被誉为“第一金属”,铁及其化合物在生活中有广泛应用。
-
(1) 基态Fe3+的电子排布式为。
-
(2) FeCl3的熔点为306℃,沸点为315℃。FeCl3的晶体类型是。FeSO4常作补铁剂,SO
 的立体构型是。
的立体构型是。
-
(3) 羰基铁[Fe(CO)5]可作催化剂、汽油抗暴剂等。1mol其分子中含molσ键。
-
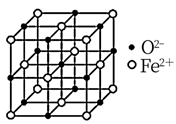
(4) 氧化亚铁晶体的晶胞如图所示。已知:氧化亚铁晶体的密度为ρg·cm-3 , NA代表阿伏加德罗常数的值。在该晶胞中,与Fe2+紧邻且等距离的Fe2+数目为;Fe2+与O2-的最短核间距为 pm。
-
(5) 某研究小组为了探究一种含铁无机矿物盐X(仅含四种元素)的组成和性质,设计并完成了如图实验:
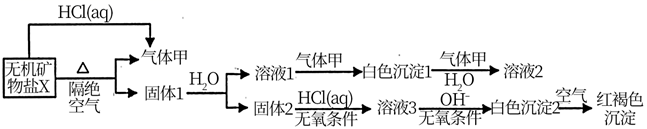
另取10.80gX在惰性气流中加热至完全分解,得到6.40g固体1。
①X的化学式是,在惰性气流中加热X至完全分解的化学方程式为。
②白色沉淀2在空气中变成红褐色沉淀的原因是 (用化学反应方程式表示)。
北京大学和中国科学院的化学工作者合作,已成功研制出碱金属与C60形成的球碳盐K3C60。实验测知该物质属于离子晶体,具有良好的超导性。下列关于K3C60的组成和结构分析正确的是( )
A . K3C60中既有离子键又有极性键
B . 1molK3C60中含有的离子数目为63×6.02×1023
C . 该晶体在熔融状态下能导电
D . 该物质的化学式可写作KC20
下列说法中错误的是( )
A . 非金属元素间不可能形成离子键
B . 两个非金属原子之间形成的化学键一定是共价键
C . 含有离子键的物质不可能是单质
D . 单质中不一定含有共价键
 、
、  、
、  、
、  、
、 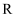 是原子序数依次增大的5种短周期主族元素。5种元素中只有
是原子序数依次增大的5种短周期主族元素。5种元素中只有  为金属;
为金属;  和
和  的最外层电子数相等;
的最外层电子数相等;  的某种核素常用来测定一些文物的年代;
的某种核素常用来测定一些文物的年代;  、
、 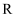 同主族,且
同主族,且  与
与  可形成一种淡黄色的固体化合物。下列说法正确的是( )
可形成一种淡黄色的固体化合物。下列说法正确的是( )
A .  的氢化物的沸点比
的氢化物的沸点比  的氢化物的沸点高
B .
的氢化物的沸点高
B .  与
与 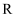 形成的四核化合物既有离子键又有共价键
C . 由
形成的四核化合物既有离子键又有共价键
C . 由  、
、  、
、  、
、 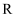 四种元素形成的化合物一定是
四种元素形成的化合物一定是  D .
D .  均可与其余4种元素形成化合物,且
均可与其余4种元素形成化合物,且  元素的化合价都是+1价
元素的化合价都是+1价
 的氢化物的沸点比
的氢化物的沸点比  的氢化物的沸点高
B .
的氢化物的沸点高
B .  与
与 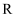 形成的四核化合物既有离子键又有共价键
C . 由
形成的四核化合物既有离子键又有共价键
C . 由  、
、  、
、  、
、 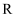 四种元素形成的化合物一定是
四种元素形成的化合物一定是  D .
D .  均可与其余4种元素形成化合物,且
均可与其余4种元素形成化合物,且  元素的化合价都是+1价
元素的化合价都是+1价
W、X、Y、Z是四种原子序数依次增大的短周期元素。a、b、c、d、e是由这些元素组成的化合物,气体a的水溶液呈碱性,c为红棕色气体,e是由W、Y、Z元素形成的化合物,m为元素Y形成的单质。上述物质 的转化关系如图所示,下列说法正确的是 ( )

A . 简单离子半径: Z> Y
B . c是由极性键构成的非极性分子
C . e为离子化合物,含有离子键和共价键
D . W、X、Y形成的化合物不可能是离子化合物
最近更新



