化学键 知识点题库
在1×105Pa和298K时,将1mol气态AB分子分离成气态A原子和B原子所需要的能量成为键能(kJ•mol﹣1).下面是一些共价键的键能:(已知氨分子中有三个等价的氮氢共价键)
共价键 | H2分子 | N2分子 | NH3分子 |
键能(kJ•mol﹣1) | 436 | 945 | 391 |
(1)根据上表中的数据判断工业合成氨的反应是 (填“吸热”或“放热”)反应;
(2)在298K时,取1mol氮气和3mol氢气放入一密闭容器中,在催化剂存在下进行反应.理论上放出或吸收的热量为Q1 , 则Q1为
根据所学知识完成题目:
-
(1) 中国古代四大发明之一﹣﹣黑火药,它的爆炸反应为:2KNO3+3C+S
 A+N2↑+3CO2↑(已配平)
A+N2↑+3CO2↑(已配平) ①除S外,上述元素的电负性从大到小依次为;
②在生成物中,含极性共价键的分子的中心原子轨道杂化类型为,A的晶体类型为.
③已知CN﹣与N2结构相似,推算HCN分子中σ键与π键数目之比为.
-
(2) 原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2;T的基态原子外围电子(价电子)排布为,Q2+的未成对电子数是.
-
(3) 在CrCl3的水溶液中,一定条件下存在组成为[CrCln(H2O)6﹣n]x+(n和x均为正整数)的配离子,将其通过氢离子交换树脂(R﹣H),可发生离子交换反应:[CrCln(H2O)6﹣n]x++xR﹣H→Rx[CrCln(H2O)6﹣n]+xH+交换出来的H+经中和滴定,即可求出x和n,确定配离子的组成.将含0.0015mol[CrCln(H2O)6﹣n]x+的溶液,与R﹣H完全交换后,中和生成的H+需浓度为0.1200mol•L﹣1NaOH溶液25.00mL,可知该配离子的化学式为.
下列各组物质的晶体中,化学键类型和晶体类型均相同的是( )
A . NH3和NH4Cl
B . HCl和SiO2
C . CO2和H2O
D . KCl和K
下列每组物质中化学键类型和分子的极性都相同的是( )
A . CO2和CS2
B . NaCl和HCl
C . H2O和CH4
D . O2和HBr
下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A . CO2和H2O
B . CCl4和KCl
C . NaCl和HCl
D . SO2和SiO2
下列物质中,既有离子键,又有共价键的是( )
A . CaCl2
B . KOH
C . H2O
D . N2
固体冰中不存在的作用力是( )
A . 离子键
B . 极性键
C . 氢键
D . 范德华力
毒奶粉主要是奶粉中含有有毒的三聚氰胺(  ).下列关于三聚氰胺分子的说法中正确的是( )
).下列关于三聚氰胺分子的说法中正确的是( )
 ).下列关于三聚氰胺分子的说法中正确的是( )
).下列关于三聚氰胺分子的说法中正确的是( )
A . 所有氮原子均采取sp3杂化
B . 一个三聚氰胺分子中共含有15个σ键
C . 属于极性分子
D . 三聚氰胺分子中同时含有极性键和非极性键
写出下列物质的电子式,在括号内指出所含化学键的类型.
-
(1) CO2:;
-
(2) NaOH:;
-
(3) 四核10电子的共价化合物:;
-
(4) 五核10电子的阳离子:.
下列有关化学键的叙述,正确的是( )
A . 仅含有共价键的物质定是共价化合物
B . 单质分子中均存在化学键
C . 离子化合物中一定含有离子键,可能含有配位键和共价键
D . 由不同种非属元素的原子形成的共价化合物一定只含极性键
下列各组中每种物质都既有离子键又有共价键的一组是( )
A . NaOH H2SO4 (NH4)2SO4
B . MgO Na2SO4 HNO3
C . Na2O2 KOH Na3PO4
D . HCl Al2O3 MgCl2
原子序数依次增加的前四周期的主族元素A~I,有关性质如下:
|
元素代号 |
A |
B |
C |
D |
E |
F |
G |
H |
I |
|
原子半径/nm |
0.037 |
0.074 |
0.073 |
0.071 |
0.143 |
0.102 |
0.099 |
0.197 |
0.114 |
|
主要化合价 |
+1 |
+5、-3 |
-2 |
-1 |
+4、-4 |
+6、-2 |
+7、-1 |
+2 |
+7、-1 |
已知E的单质是一种常见的半导体材料,分析表中数据,回答有关问题:
-
(1) 元素G在周期表中的位置是,元素C的气态氢化物的电子式为。
-
(2) 元素A、B、G可形成化合物B A4G,该化合物中存在的化学键有, E的单质晶体属于晶体(填“离子”、“分子”或“原子”),
-
(3) 元素D、G、I的非金属性由强到弱的顺序是(用元素符号表示),
-
(4) 元素C,D的气态氢化物的稳定性顺序为(用化学式表示),元素D的单质可以将元素C从化合物A2C中置换出来,该置换反应的化学方程式为。
下列叙述正确的是( )
A . Li、Na、K、Rb四种单质中,Rb的熔点最高
B . 氯化钙的电子式为 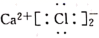 C . 离子化合物一定只含离子键
D . HF的热稳定性强于HCl,说明非金属性:F>Cl
C . 离子化合物一定只含离子键
D . HF的热稳定性强于HCl,说明非金属性:F>Cl
下列叙述正确的是( )
A . 离子化合物中不可能含共价键
B . 活泼金属与活泼非金属化合时能形成离子键
C . 由非金属元素形成的化合物一定是共价化合物
D . 共价化合物不可能含有离子键,熔融状态可以导电
碳是形成单质和化合物种类最多的元素,其单质及化合物有独特的性质和用途。请回答下列问题。
-
(1) 碳有多种单质,其中石墨烯与金刚石的晶体结构如图所示:
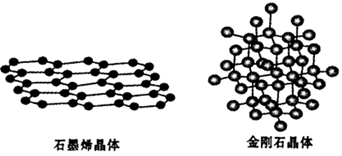
石墨烯能导电而金刚石不能导电的原因是。
-
(2) 碳的主要氧化物有CO和CO2
①CO能与金属Fe形成一种浅黄色液体Fe(CO)5 , 其熔点为-20℃,沸点为103℃,热稳定性较高,易溶于苯等有机溶剂,不溶于水。据此判断:该化合物的晶体中不涉及的作用力有。
A.离子键 B.极性键 C.非极性键 D.范德华力 E.配位键
②CO2在一定条件下可以合成甲醇,反应方程式为:
 。该反应所涉及的4种物质,沸点从高到低的顺序为。
。该反应所涉及的4种物质,沸点从高到低的顺序为。 -
(3)
 是重要的有机反应中间体,其空间构型为。
是重要的有机反应中间体,其空间构型为。
-
(4) 碳的有机物常作为金属有机化合物的配体,如EDTA(乙二胺四乙酸)。EDTA与Ca2+形成的配离子如图所示。

①钙离子的配位数是。
②配体中碳原子的杂化方式有。
在下列各组物质中,化学键类型完全相同的是( )
A . NH4Cl和NaOH
B . H2O2和Na2O2
C . CO2和Ar
D . KCl和Na2O
南京理工大学团队成功合成了能在室温下稳定存在的五氮阴离子盐(N5)6(H3O)3(NH4)4Cl,五氮阴离子N  是制备全氮类物质N
是制备全氮类物质N  N
N  的重要中间体。下列说法正确的是( )
的重要中间体。下列说法正确的是( )
 是制备全氮类物质N
是制备全氮类物质N  N
N  的重要中间体。下列说法正确的是( )
的重要中间体。下列说法正确的是( )
A . (N5)6(H3O)3(NH4)4Cl中含有共价键,属于共价化合物
B . (N5)6(H3O)3(NH4)4Cl中的H3O+与NH  含有的电子数不相同
C . 1molN
含有的电子数不相同
C . 1molN  N
N  中含有70mol电子,N
中含有70mol电子,N  N
N  与N2属于同素异形体
D . N
与N2属于同素异形体
D . N  N
N  中含有共价键和离子键,属于离子化合物
中含有共价键和离子键,属于离子化合物
 含有的电子数不相同
C . 1molN
含有的电子数不相同
C . 1molN  N
N  中含有70mol电子,N
中含有70mol电子,N  N
N  与N2属于同素异形体
D . N
与N2属于同素异形体
D . N  N
N  中含有共价键和离子键,属于离子化合物
中含有共价键和离子键,属于离子化合物
下列微粒中含有化学键的是( )
A . OH-
B . Cl-
C . Na+
D . Ar
2020年12月17日凌晨1时59分,“嫦娥五号”首次实现了我国地外天体采样返回目标,标志着我国航天事业迈出了一大步。带回的月壤中包含了H、O、N、Al、S、Cd、Zn、Ti、Cu、Au、Cr等多种元素。回答下列问题:
-
(1) 一些氧化物的熔点如表所示:
氧化物
Li2O
MgO
P4O6
SO2
熔点/℃
1570
2800
23.8
-75.5
解释表中氧化物之间熔点差异的原因:。
-
(2) Cr2O
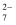 的结构如图所示。则该离子中σ键与π键的个数比为。
的结构如图所示。则该离子中σ键与π键的个数比为。
-
(3) [Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O的空间结构和相应的键角如图所示。

H2O的键角小于NH3的键角,原因是。
-
(4) 钛某配合物可用于催化环烯烃聚合,其结构如图所示。

该配合物中存在的化学键有____(填字母代号)。
A . 离子键 B . 配位键 C . 金属键 D . 共价键 E . 氢键 -
(5) 已知TiO2与浓硫酸反应生成硫酸氧钛,硫酸氧钛晶体中阳离子为链状聚合形式的离子,结构如图所示,该阳离子的化学式为,阴离子的空间构型为。

-
(6) 已知TiN晶体的晶胞结构如图所示,若该晶胞中Ti原子与N原子的最近距离为apm,阿伏加德罗常数的值为NA , 则晶胞的密度为g·cm-3。[M(TiN)=62g·mol-1 , 用含a、NA的代数式表示]。

下列关于晶体的描述中,正确的是( )
A . 碘晶体升华时破坏了共价键
B . 分子晶体中分子间作用力越大,分子越稳定
C . 用X射线衍射实验可以区分晶体和非晶体
D . 氯化钠和铁融化时克服的粒子间作用力是同种类型
最近更新



