离子化合物的结构特征与性质 知识点题库
下列物质属于离子化合物的是( )
A . C60
B . HCl
C . C6H6
D . CaCl2
下列各组原子序数所表示的两种元素,能形成AB2型离子化合物的是( )
A . 6和8
B . 11和13
C . 11和16
D . 12和17
下列物质中,含有共价键的离子化合物的是( )
A . MgCl2
B . HCl
C . H2O
D . NaOH
下列物质中含有离子键的是( )
A . CO2
B . NaCl
C . HCl
D . CH4
下列物质中,只含有离子键的是( )
A . NaOH
B . NH3
C . CaCl2
D . H2SO4
下列物质中,既含离子键、又含共价键的是( )
A . NaOH
B . Na2O
C . H2O
D . CaCl2
下列关于离子化合物的叙述正确的是( )
A . 离子化合物中都含有离子键
B . 离子化合物中的阳离子只能是金属离子
C . 离子化合物一定可以导电
D . 溶于水可以导电的化合物一定是离子化合物
下列物质中:①N2 ②MgCl2 ③NH4Cl ④CH4 ⑤CO2⑥Ne ⑦H2S ⑧KOH ⑨Na2O2 ⑩K2O
-
(1) 只存在离子键的是.(填序号,以下同.)
-
(2) 只存在共价键的是.
-
(3) 没有化学键的是.
-
(4) 属于离子化合物的是.
-
(5) 属于共价化合物的是.
下列性质可以证明某化合物内一定存在离子键的是( )
A . 可溶于水
B . 熔融状态能导电
C . 水溶液能导电
D . 具有较高熔点
无机物氰酸铵(NH4OCN)受热可转化为有机物尿素[CO(NH2)2],这一反应的发现使人类踏上了有机合成的征程。下列关于这两种物质的说法中正确的是( )
A . 都属于铵盐
B . 都属于离子化合物
C . 互为同素异形体
D . 互为同分异构体
下列物质中含有共价键的离子化合物是( )
A . NaOH
B . CaCl2
C . H2
D . H2O
下列关于共价化合物和离子化合物说法正确的是( )
A . 只含共价键的物质一定是共价化合物
B . 离子化合物都能溶于水,且熔点一般都较高
C . 全由非金属元素组成的化合物中可能含有离子键
D . 气态单质分子中一定含有非极性共价键
下列说法正确的是( )
A . 气态单质分子中一定含有非极性共价键
B . 含有共价键的化合物可能是共价化合物,也可能是离子化合物
C . 离子键是由阴、阳离子通过静电引力达到平衡时形成的,含有离子键的化合物一定是离子化合物
D . 双原子气体分子中的共价键一定是非极性键
下列有关说法正确的是( )
A . 该组化合物中只含有共价键:H2O、NH4Cl、H2O2
B . 非金属原子间以共价键结合的物质都是共价化合物
C . Na2O、NaOH和Na2SO4为离子化合物,HCl、NH3、NH4NO3、H2SO4为共价化合物
D . 共价化合物是原子间通过共用电子对形成的
下列不是离子化合物的是( )
A . H2O
B . CaI2
C . KOH
D . NaNO3
下列叙述中正确的是 ( )
A . 含离子键的化合物一定是离子化合物
B . 含共价键的化合物一定是共价化合物
C . 全部由非金属元素形成的化合物一定是共价化合物
D . 在离子化合物中也可能含有金属键
下列物质中,只含有离子键的化合物是( )
A . 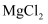 B .
B .  C .
C .  D .
D . 
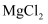 B .
B .  C .
C .  D .
D . 
下列说法错误的是( )
A . 用电子式表示K2S的形成过程为:  B . MgCl2和NaOH中的化学键类型完全相同,都属于离子化合物
C . CO2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D . 反应2H2O+2F2=O2+4HF,同时有极性键和非极性键的断裂和形成
B . MgCl2和NaOH中的化学键类型完全相同,都属于离子化合物
C . CO2和Cl2两种分子中,每个原子的最外层都具有8电子稳定结构
D . 反应2H2O+2F2=O2+4HF,同时有极性键和非极性键的断裂和形成
下列说法错误的是( )
A . 晶体熔点由低到高:CO<KCl<SiO2
B . H2O的熔、沸点高于H2S是由于H2O分子之间存在氢键
C . NaCl晶体溶于水,离子键被破坏
D . 碘的升华和白磷的熔化所需破坏的化学键相同.
下列物质中,既存在离子键又存在共价键的是( )
A . 氯化氢
B . 氯化镁
C . 氮气
D . 氢氧化钠
最近更新



