离子化合物的结构特征与性质 知识点题库
有下列物质:①N2 ②Na2O ③NaOH ④CH4 ⑤CO2 ⑥MgF2 ⑦NH4Cl
-
(1) 只由离子键构成的物质是.
-
(2) 只由极性键构成的物质是.
-
(3) 只由非极性键构成的物质是.
-
(4) 只由非金属元素组成的离子化合物是.
-
(5) 请写出②Na2O和④CH4的电子式、.
-
(6) 请用电子式表示⑤CO2 ⑥MgF2 的形成过程.CO2: MgF2:.
下列关于NaCl的说法不正确的是( )
A . 给NaCl溶液通电,使NaCl发生电离
B . NaCl是电解质
C . NaCl的电离方程式是:NaCl═Na++Cl﹣
D . NaCl溶液能导电,是因为溶液中有自由移动的离子
下列四种固体物质中,既存在离子键又存在共价键的是( )
A . NH4Cl
B . HCl
C . MgCl2
D . CH4
下列化合物中既有离子键又有共价键的是( )
A . MgCl2
B . NaOH
C . HBr
D . N2
下列各组物质的分类正确的是( )
①混合物:氯水、氨水、水玻璃、水银、福尔马林、聚乙烯
②电解质:明矾、冰醋酸、石膏、纯碱
③CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2为碱性氧化物
④同位素:1H+、2H2、3H
⑤同素异形体:C60、C80、金刚石、石墨
⑥同系物:CH2O2、C2H4O2、C3H6O2、C4H8O2
⑦同分异构体:乙二酸二乙酯、乙二酸乙二酯
⑧根据酸分子中含有的H原子个数将酸分为一元酸、二元酸、多元酸
⑨在熔化状态下能导电的化合物为离子化合物.
A . ②⑤⑨
B . ①②⑤⑦⑨
C . ②④⑤⑥⑦⑨
D . 全部正确
物质的下列性质能肯定该物质为离子化合物的是( )
A . 水溶液能导电的化合物
B . 由金属元素和非金属元素组成的化合物
C . 在熔化状态下能导电的化合物
D . 熔点高的物质
下列有关说法正确的是( )
A . NaOH是只含离子键的离子化合物
B . HCl溶于水没有破坏共价键
C . 碳在O2中燃烧时,破坏碳和O2中化学键吸收的总能量大于形成CO2中化学键释放的总能量
D . 在Cl2+2NaBr=2NaCl+Br2反应过程中有离子键和共价键的断裂,也有离子键和共价键形成
在氢、氮、氯和钠四种元素中:
-
(1) 四种元素中最外层电子数最多的原子的结构示意图为.
-
(2) 由2种元素组成的共价化合物的水溶液显酸性,这种化合物的电子式是;由两种元素组成的共价化合物的水溶液呈碱性,这种化合物的结构式为,四种元素对应的化学性质最稳定的单质的电子式为.
-
(3) 由两种元素组成的离子化合物,其化学式为,由三种元素组成的离子化合物,用电子式表示其形成过程.
-
(4) 与氯同属卤族元素的各元素的氢化物中稳定性最好的是,其稳定的原因是.
下列叙述正确的是( )
A . 非极性键可能存在单质中,也可能存在化合物中
B . 含有离子键的化合物不可能含有非极性键
C . 盐酸中含有H+和Cl- , 故HCl为离子化合物
D . 含有共价键的化合物不可能是离子化合物
下列含有共价键的离子化合物是( )
A . CO2
B . NaOH
C . CaF2
D . 金刚石
下列说法中错误的是( )。
A . 离子化合物中不一定含有金属元素
B . 由不同原子所形成的纯净物一定是化合物
C . 在含有阳离子的化合物中,一定含有阴离子
D . 含有金属元素的离子不一定是阳离子
下列说法正确的是( )
①离子化合物中一定有离子键,可能有共价键 ②离子化合物都属于强电解质
③非金属单质中不含离子键,一定只含有共价键 ④稳定性:H2O>H2S,沸点:H2O<H2S
⑤NaCl和HCl溶于水破坏相同的作用力
⑥非极性键可能存在于非金属单质中,也可能存在于离子化合物或共价化合物中
A . ①②⑥
B . ①③④⑥
C . ③④⑤⑥
D . ①④⑤
A、B、C、D、E、F、G是周期表中短周期的七种元素,有关性质或结构信息如下表:
|
元素 |
有关性质或结构信息 |
|
A |
其一种单质可吸收紫外线,是地球的保护伞 |
|
B |
B阳离子与A阴离子电子数相同,且是所在周期中单核离子半径最小的 |
|
C |
C与B同周期,且是所在周期中原子半径最大的(稀有气体除外) |
|
D |
D原子最外层电子数是电子层数的2倍,其氢化物有臭鸡蛋气味 |
|
E |
E与D同周期,且在该周期中原子半径最小 |
|
F |
F的氢化物和最高价氧化物的水化物反应生成一种离子化合物 |
|
G |
G是形成化合物种类最多的元素 |
-
(1) B元素符号为,G的元素名称为,它的一种同位素可测定文物年代,这种同位素的符号是。
-
(2) A与C以原子个数比为1:1形成的一种化合物,其所属化合物类型为(填“离子化合物”或“共价化合物”),包含的化学键有(填“离子键”、“极性共价键”或“非极性共价键”)。
-
(3) F常温下可以形成两种用途广泛的氢化物,它们的电子式分别为和,并用电子式表示出其最简单气态氢化物的形成过程。
-
(4) D在元素周期表中的位置,D与E相比非金属性较强的是 (填元素名称),请从原子结构的角度解释原因:。
-
(5) KClO3可用于实验室制O2 , 若不加催化剂,400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种盐的阴阳离子个数比为1:1。写出该反应的化学方程式:。
下列说法中错误的是( )
A . 在共价化合物中不可能含有离子键
B . 非金属之间形成的化学键一定是共价键
C . 含有共价键的化合物不一定是共价化合物
D . 含有离子键的化合物一定是离子化合物
下列说法错误的是( )
A . HClO、N2和 Na2O等物质中,各原子或离子的最外层均达到了稳定结构
B . 石英和金刚石都是原子间通过共价键结合形成的原子晶体
C . 某化合物在熔融状态下能导电,则一定是离子化合物
D . HF 的热稳定性比 HBr 强是因为 HF 的分子间作用力强
下列数据是对应物质的熔点,有关判断错误的是( )
| 物质 | Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 熔点 | 920℃ | 97.8℃ | 1291℃ | 190℃ | 2073℃ | -107℃ | -57℃ | 1723℃ |
A . 晶格能:Al2O3>AlF3
B . 同族元素的氧化物可形成不同类型的晶体
C . 金属晶体的熔点不一定比分子晶体的高
D . 由金属元素和非金属元素形成的化合物就一定是离子化合物
下列化学用语表示正确的是( )
A . N2H4的结构式: 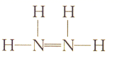 B . Al3+的结构示意图:
B . Al3+的结构示意图:  C . BF3的电子式:
C . BF3的电子式: 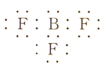 D . 异戊二烯的球棍模型:
D . 异戊二烯的球棍模型: 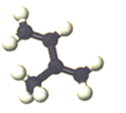
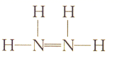 B . Al3+的结构示意图:
B . Al3+的结构示意图:  C . BF3的电子式:
C . BF3的电子式: 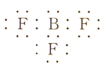 D . 异戊二烯的球棍模型:
D . 异戊二烯的球棍模型: 
下列化合物中,既含有离子键又含有共价键的是( )
A . CO2
B . KCl
C . NH4Cl
D . CaCl2
下列说法正确的是( )
A . 氢元素和其他元素可形成共价化合物,也可形成离子化合物
B . 离子化合物中只含离子键,共价化合物中只含共价键
C . 碘晶体升华、HCl气体溶于水都有共价键被破坏
D . NaCl晶体中,Na+和Cl-之间通过静电引力形成离子键
NaI晶体中两核间距约0.28 nm,呈共价键;激光脉冲照射NaI时,Na+和I—两核间距为1.0~1.5 nm,呈离子键。下列说法正确的是( )
A . 离子化合物中不可能含共价键
B . 共价键和离子键之间没有明显界线
C . NaI晶体中既有离子键又有共价键
D . NaI晶体是离子化合物和共价化合物的混合物
最近更新



