分子晶体 知识点
分子晶体 知识点题库
三种晶体熔点由高到低的顺序是。
(2)下列六种晶体:①CO2、②NaCl、③Na、④Si、⑤CS2、⑥金刚石,它们的熔点从低到高的顺序为(填序号)。
(3)在H2、(NH4)2SO4、SiC、CO2、HF中,由极性键形成的非极性分子有,由非极性键形成的非极性分子有,
能形成分子晶体的物质是,含有氢键的晶体的化学式是,属于离子晶体的是,
属于原子晶体的是,五种物质的熔点由高到低的顺序是。
-
(1) 下列是钠、碘、金刚石、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是;(请用相应的编号填写)

-
(2) 已知:晶体二氧化硅可由晶体硅衍生得到;下图是晶体硅及二氧化硅的晶胞示意图:
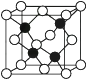
图1 晶体Si的晶胞
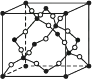
图2 晶体SiO2的晶胞
由图示可知两者形成的晶体的类型是,请写出与晶体SiO2化学键及晶体类型完全相同的两种物质的名称:;
-
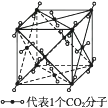
(3) 干冰晶体是一种面心立方结构,如图所示,即每8个CO2构成立方体,且在6个面的中心上又各有1个CO2分子,在每个CO2周围紧邻(其中a为立方体棱长)的CO2有个。
晶体 | NaCl | KCl | AlCl3 | SiCl4 | 单质B |
熔点/℃ | 810 | 776 | 190 | -68 | 2300 |
沸点/℃ | 1465 | 1418 | 180 | 57 | 2500 |
-
(1) 甲烷分子的空间构型为,可燃冰(mCH4·nH2O)属于晶体。
-
(2) 已知25 ℃、101 kPa 时,1 g甲烷完全燃烧生成液态水放出55.64 kJ热量,则该条件下反应
CH4(g)+2O2 (g)=CO2 (g)+2H2O (l)的ΔH=kJ/mol
-
(3) 甲烷高温分解生成氢气和碳。在密闭容器中进行此反应时要通入适量空气使部分甲烷燃烧,其目的是。
-
(4) 用甲烷空气碱性(KOH溶液)燃料电池作电源,电解CuCl2溶液。装置如图所示:

①a电极名称为。
②c电极的电极反应式为。
③假设CuCl2溶液足量,当某电极上析出3.2 g 金属Cu时,理论上燃料电池消耗的空气在标准状况下的体积是L(空气中O2体积分数约为20%)。
NaCl | MgCl2 | AlCl3 | SiCl4 | CaCl2 | |
熔点/℃ | 801 | 712 | 190 | -68 | 782 |
沸点/℃ | 1 465 | 1 418 | 230 | 57 | 1 600 |
根据这些数据分析,他们认为属于分子晶体的是 ( )
A组 | B组 | C组 | D组 |
金刚石:3 550 | Li:181 | HF:-83 | NaCl:801 |
硅晶体:1 410 | Na:98 | HCl:-115 | KCl:776 |
硼晶体:2 300 | K:64 | HBr:-89 | RbCl:718 |
二氧化硅:1 723 | Rb:39 | HI:-51 | CsCl:645 |
据此回答下列问题:
-
(1) A组属于晶体,其熔化时克服的微粒间的作用力是。
-
(2) B组晶体共同的物理性质是 (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
-
(3) C组中HF熔点反常是由于 。
-
(4) D组晶体可能具有的性质是(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电
④熔融状态能导电
-
(5) D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为 。
-
(1) 基态铬原子核外存在 对自旋相反的电子,其未成对电子有种空间伸展方向。铁和锰的第三电离能(I3)较大的是(填元素符号),原因是。
-
(2) 环戊二烯
 ,无色液体,熔点-97.5℃,沸点40. 0℃,存在于煤焦油中。
,无色液体,熔点-97.5℃,沸点40. 0℃,存在于煤焦油中。 ①环戊二烯物质中存在的微粒间相互作用有
A 范德华力 B 氢键 C δ键 D π键
②环戊二烯分子中碳原子的杂化轨道类型是
③配合物中配体提供电子对的方式包括孤对电子、π电子等。二茂铁的分子结构如图所示,其中铁的配位数是。
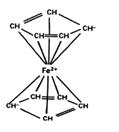
-
(3) 金属锰的一种面心立方晶胞结构示意图如图所示,已知锰原子半径为141. 4pm,则该晶胞参数a= 。由于晶体缺陷造成晶体结构中部分原子缺失,测得实际密度为5. 52g·cm-3 , Mn元素相对原子质量按为54. 94计算,此晶胞的缺陷率为(缺陷率为单位体积内缺失原子数占应有原子总数的百分比)。
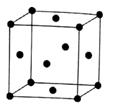
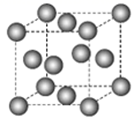
 分子有12个紧邻的甲烷分子
C .
分子有12个紧邻的甲烷分子
C .  晶体熔化时需克服共价键
D . 一个甲烷晶胞中含有8个
晶体熔化时需克服共价键
D . 一个甲烷晶胞中含有8个  分子
分子
-
(1) 比较NaHCO3与NaAlO2结合氢离子能力的强弱,用一个离子方程式加以说明:。
-
(2) 画出NH3·H2O的结构。 (氢键可用X…H-Y来表示)
-
(3) 常压下,AlF3的熔点(1040℃)比AlCl3的熔点(194℃)高,原因是。
①分子晶体中,分子间作用力越大,对应的物质越稳定
②离子晶体在熔融状态下可以导电
③金刚石比金刚砂的熔点高
④石英和晶体硅都是共价晶体,最小环上都有6个原子
⑤Al2O3晶体中离子键成分百分数较小,所以可以当作共价晶体
⑥石墨晶体中只有σ键
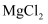 、
、 )为原料制备无水
)为原料制备无水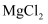 的工艺流程如下:
的工艺流程如下: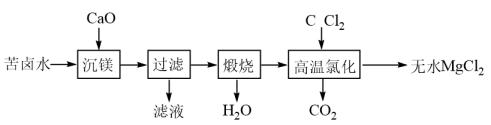
下列说法正确的是( )
 、
、 、
、 B . “煅烧”后的产物溶于稀盐酸,将所得
B . “煅烧”后的产物溶于稀盐酸,将所得 溶液加热蒸干也可得到无水
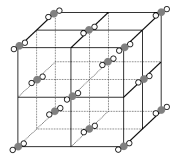
溶液加热蒸干也可得到无水 C . 1个干冰晶胞(见右图)中含14个
C . 1个干冰晶胞(见右图)中含14个 D . “高温氯化”时的反应为
D . “高温氯化”时的反应为



