分子晶体 知识点题库
水的状态除了气态、液态和固态外,还有玻璃态。它是由液态水急速冷却到165K时形成的,玻璃态的水无固定形状,不存在晶体结构,且密度与普通液态水的密度相同,有关玻璃态水的叙述正确的是( )
A . 玻璃态是水的一种特殊状态
B . 水由液态变为玻璃态,体积膨胀
C . 玻璃态水是分子晶体
D . 水由液态变为玻璃态,体积缩小
下列有关物质的结构和性质的叙述错误的是( )
A . 水是一种非常稳定的化合物,这是由于水中存在氢键
B . 由极性键形成的分子可能是非极性分子
C . 水和冰中都含有氢键
D . 分子晶体中一定存在范德华力,可能有共价键
氯化硼的熔点为10.7℃,在氯化硼分子中,Cl﹣B﹣Cl键角为120℃,它可以水解,水解产物之一是硼酸(H3BO3).下列有磁氯化硼的叙述正确的是( )
A . 氯化硼是原子晶体
B . 熔化时,氯化硼能导电
C . 氯化硼分子是一种非极性分子
D . 氯化硼水解得到两种弱酸
一定条件下,Ni2+与丁二酮肟生成鲜红色沉淀A.
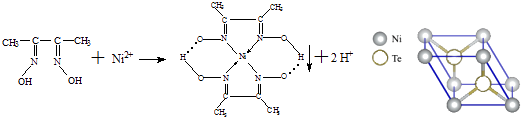
-
(1) 基态Ni2+的核外电子排布式为.
-
(2) 丁二酮肟组成元素中C,N,O的电负性由大到小的顺序为.
-
(3) 元素Ni的一种碲(Te)化物晶体的晶胞结构如图所示,则该化合物的化学式为.
-
(4) Ni(CO)4是一种无色液体,沸点为42.1℃,熔点为﹣19.3℃.Ni(CO)4的晶体类型是.
-
(5) 人们在研究分子结构时发现,CO与N2分子结构非常相似,我们把具有相同价电子数和相同原子数的分子或离子具有相同的结构特征,这一原理称为“等电子体”.请写出一种由第二周期主族元素组成的且与CO互为等电子体的阴离子的电子式.
-
(6) 对于A物质:
①该结构中,碳碳之间的共价键类型是σ键,碳氮之间的共价键类型是,氮镍之间形成的化学键是;
②该结构中,氧氢之间除共价键外还可存在.
碘晶体升华时,下列所述内容发生改变的是( )
A . 分子内共价键
B . 分子间的作用力
C . 碘分子的大小
D . 分子内共价键的键长
下列关于晶体的说法中正确的是( )
A . 分子晶体内一定存在共价键
B . 分子晶体中分子间作用力越大,分子越稳定
C . 冰融化时水分子中的共价键没有断裂
D . 由金属元素和非金属元素形成的化合物一定是离子化合物,其晶体一定不是分子晶体
科学家发现的C60是一种新的分子,它具有空心、类似于足球的结构。最近科学家又确认存在着另一种分子“N60”,它与C60的结构相似,在高温或机械撞击时,其积蓄的巨大能量会在一瞬间释放出来。下列关于N60的说法中不正确的是( )
A . N60是由共价键结合而成的空心球状结构
B . N60和14N都是氮的同位素
C . N60的熔、沸点不高
D . N60可能成为很好的火箭燃料
SiCl4的分子结构与CCl4类似,对其作出如下推断,其中正确的是( )
①SiCl4晶体是分子晶体 ②常温、常压下,SiCl4是液体 ③SiCl4分子是由极性键形成的非极性分子 ④SiCl4的熔点高于CCl4的
A . ①
B . ①②
C . ②③
D . ①②③④
Ⅰ.已知A、B、C、D四种分子所含原子的数目依次为 1、3、6、6,且都含有18个电子,B、C是由两种元素的原子组成,且分子中两种原子的个数比均为1∶2。D是一种有毒的有机物。
-
(1) 组成A分子的原子的元素符号是。
-
(2) 从B分子的立体结构判断,该分子属于(填“极性”或“非极性”)分子。
-
(3) C分子中包含个σ键,个π键。
-
(4) D的熔、沸点比C2H6的熔、沸点高,其主要原因是(需指明D是何物质): 。
-
(5) Ⅱ.CO的结构可表示为
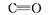 ,N2的结构可表示为
,N2的结构可表示为 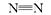 。
。 下表是两者的键能数据:(单位:kJ·mol-1)
A—B
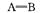
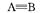
CO
357.7
798.9
1 071.9
N2
154.8
418.4
941.7
结合数据说明CO比N2活泼的原因:。
-
(6) Ⅲ.Fe、Co、Ni、Cu等金属能形成配合物与这些金属原子的电子层结构有关。
基态Ni原子的核外电子排布式为,基态Cu原子的外围电子排布式为。
-
(7) Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于(填晶体类型)。
正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中错误( )
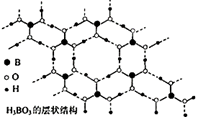
A . 正硼酸晶体属于分子晶体
B . 正硼酸分子的稳定性与氢键无关
C . 1molH3BO3晶体中含有3mol氢键
D . B原子杂化轨道的类型sp2 , 层间的H3BO3分子通过共价键相连
以氮化镓(GaN)、砷化镓(GaAs)为代表的第三代半导体材料目前已成为全球半导体研究的前沿和热点,如砷化镓灯泡寿命是普通灯泡的100倍,而耗能即为10%,推广砷化镓等发光二极管(LED)照明,是节能减排的有效举措。请回答下列问题:
-
(1) 基态镓原子的价电子排布式为。
-
(2) 镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1985、2962、6192,由此可推知镓的主要化合价为和+3。砷的电负性比镓 (填“大”或“小”)。
-
(3) 比较下列镓的卤化物的熔点和沸点,GaCl3、GaBr3、GaI3的熔、沸点依次升高,分析其变化原因: 。
镓的卤化物
GaCl3
GaBr3
GaI3
熔点/℃
77.75
122.3
211.5
沸点/℃
201.2
279
346
GaF3的熔点超过1000℃,可能的原因是。
-
(4) ①砷化镓是将(CH3)3Ga和AsH3用MOCVD(金属有机物化学气相淀积)方法制备得到的,该反应在700℃进行,反应的方程式为:。
②反应物AsH3分子的几何构型为,(CH3)3Ga中镓原子杂化方式为。
-
(5) 砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565pm,As的配位数为,晶体的密度为 (设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。

下列说法一定正确的是( )
A . 分子晶体中都存在共价键
B . 当中心原子的配位数为6时,配合单元常呈八面体空间结构
C . SiO2晶体中每个硅原子与两个氧原子以共价键相结合
D . 金属晶体的熔点都比分子晶体的熔点高
下列晶体中分类正确的一组是( )
| 选项 | 离子晶体 | 共价晶体 | 分子晶体 |
| A | | | |
| B | | | |
| C | | 干冰 | |
| D | | 金刚石 | 玻璃 |
A . A
B . B
C . C
D . D
类推的思维方法在化学学习与研究中可能会产生错误的结论,因此类推出的结论需经过实践的检验才能确定其符合题意与否。下列几种类推结论正确的是( )
A . 金刚石中C—C键的键长为154.45pm,C60中C—C键的键长为140~145pm,所以C60的熔点高于金刚石
B . CO2晶体是分子晶体,SiO2晶体也是分子晶体
C . 从CH4、NH  、SO
、SO  为正面体结构,可推测CCl4、PH
为正面体结构,可推测CCl4、PH  、PO
、PO  也为正四面体结构
D . C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
也为正四面体结构
D . C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
 、SO
、SO  为正面体结构,可推测CCl4、PH
为正面体结构,可推测CCl4、PH  、PO
、PO  也为正四面体结构
D . C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
也为正四面体结构
D . C2H6是碳链为直线形的非极性分子,可推测C3H8也是碳链为直线形的非极性分子
氨硼烷(NH3BH3)的结构和乙烷相似,下列关于NH3BH3的叙述正确的是( )
A . 氨硼烷不溶于水
B . 氨硼烷不易被氧化
C . 分子中存在N—B共价键
D . 氨硼烷为原子晶体,具有很高的熔点
下列对一些实验事实及其理论解释都正确的是( )
选项 | 实验事实 | 理论解释 |
A |
| 同周期元素原子的电离能随原子序数增大而增大 |
B |
|
|
C | 金刚石的熔点高于石墨 | 金刚石是原子晶体,石墨是分子晶体 |
D |
|
|
A . A
B . B
C . C
D . D
X、Y、Z三种短周期元素,X和Y两种元素的核电荷数之和为22,X的原子核外电子数比Y的少6个,Z与Y同主族。下列说法中错误的是( )
A .  、
、 两者中心原子采取的杂化方式不同
B . Y的单质为共价晶体
C . Y与Z形成的化合物固态时为分子晶体
D .
两者中心原子采取的杂化方式不同
B . Y的单质为共价晶体
C . Y与Z形成的化合物固态时为分子晶体
D .  与
与 熔化时所克服的粒子间作用力相同
熔化时所克服的粒子间作用力相同
 、
、 两者中心原子采取的杂化方式不同
B . Y的单质为共价晶体
C . Y与Z形成的化合物固态时为分子晶体
D .
两者中心原子采取的杂化方式不同
B . Y的单质为共价晶体
C . Y与Z形成的化合物固态时为分子晶体
D .  与
与 熔化时所克服的粒子间作用力相同
熔化时所克服的粒子间作用力相同
碳化钼负载的层状金团簇催化剂可用于低温水煤气变换反应。下列有关说法错误的是( )
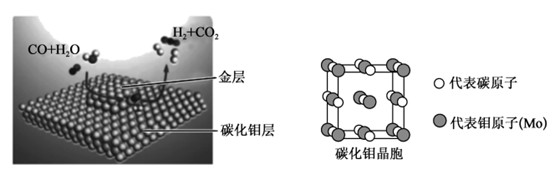
A . 碳化钼晶体的化学式为MoC
B . CO2分子中,中心原子碳的价层电子对数为2
C . 碳化钼晶胞中,离Mo最近的Mo原子为8个
D . 若碳化钼晶胞体积为V mL,则其晶体密度为 

下列说法中,正确的是( )
A . 原子晶体在熔融态时,共价键被破坏
B . 金属晶体的熔点一定比分子晶体的高
C . 干冰升华时,分子内共价键会发生断裂
D . 分子晶体中,分子间作用力越大,对应的物质越稳定
下列说法错误的是( )
A . 干冰是二氧化碳固体,干冰晶体中二氧化碳的配位数是12
B . 新戊烷[ ]分子中5个碳原子形成的空间构型是为正四面体形
C .
]分子中5个碳原子形成的空间构型是为正四面体形
C .  分子中不含环状结构且每个原子均满足8电子稳定结构,
分子中不含环状结构且每个原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为 D . 分子晶体中,共价键的键能越大,熔、沸点越高
D . 分子晶体中,共价键的键能越大,熔、沸点越高
 ]分子中5个碳原子形成的空间构型是为正四面体形
C .
]分子中5个碳原子形成的空间构型是为正四面体形
C .  分子中不含环状结构且每个原子均满足8电子稳定结构,
分子中不含环状结构且每个原子均满足8电子稳定结构, 分子中
分子中 键和
键和 键的个数比为
键的个数比为 D . 分子晶体中,共价键的键能越大,熔、沸点越高
D . 分子晶体中,共价键的键能越大,熔、沸点越高
最近更新








 原子的第一电离能小于
原子的第一电离能小于 原子
原子 为直线形分子
为直线形分子 为
为 杂化,键角为
杂化,键角为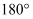
 的沸点低于
的沸点低于



