化学能与热能的相互转化 知识点题库
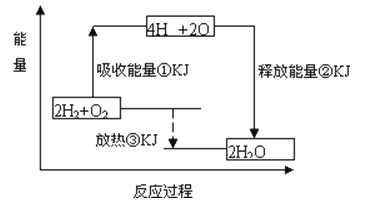
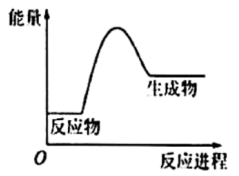
在化学反应中,随着物质的变化,化学能也发生改变,还可能伴随着不同形式的能量转化.已知:破坏1mol氢气中的化学键需要吸收436kJ能量;破坏1/2mol氧气中的化学键需要吸收249kJ的能量;形成水分子中1molH﹣O键能够释放463kJ能量.下图表示氢气和氧气反应过程中能量的变化,请将图中①、②、③的能量变化的数值,填在右边的横线上.
①KJ
② KJ
③ KJ.
(1)下列说法正确的是
A.化学反应的实质就是旧化学键的断裂,新化学键的形成,在化学反应中,反应物转化为生成物的同时,必然发生能量的变化
B.钢铁的吸氧腐蚀和析氢腐蚀的负极反应都为Fe﹣2e﹣=Fe2+
C.放热反应发生时不一定要加热,但吸热反应必须要加热才能发生
D.可逆反应在一定条件下有一定的限度,当反应进行到一定限度后,反应物不再转化为生成物
(2)25℃、101kPa条件下,8gCH4气体完全燃烧生成CO2气体和液态水放出445kJ热量.
写出CH4燃烧的热化学方程式
(3)101kPa条件下,氮气和氢气反应生成氨气的能量变化如图示意:
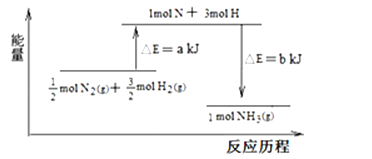
又已知:①a=1127;②25℃、101kPa下N2(g)+3H2 (g)=2NH3 (g)△H=﹣92kJ•mol﹣1则b=
拆开化学键 | 形成化学键 | 则上述反应中能量变化是多少(列出计算式)?是放热还是吸热? |
2mol H2中的化学键 | 4mol H﹣O键 | |
1mol O2中的化学键 |
(2)化学反应中的能量变化,通常表现为 ,如果反应物具有的总能量高于生成物所具有的总能量,那么该反应是 反应;反之,该反应是 反应.如Ba(OH)2•8H2O跟NH4Cl的反应就是 反应.
(3)人体内葡萄糖氧化作用可以用以下热化学方程式表示:(相对原子质量C:12 H:1 O:16)C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=﹣2804.6kJ•mol﹣1 . 若每人每天需消耗热量12558kJ,则每人每天至少需要葡萄糖多少 g.
①钢铁是常见的金属材料之一,但钢铁的腐蚀也给人类带来巨大损失,铁在潮湿的空气中锈蚀主要属于 腐蚀.请你说出防止金属腐蚀的任一种具体方法
②除金属材料外,人类还研发了许多材料,如:塑料、合成橡胶、合成纤维等,它们属于 材料.
-
(1) 天然气的主要成分甲烷燃烧生成二氧化碳和液态水的热化学方程式如下,请回答下列问题:CH4(g)+2O2(g)=CO2(g)+2H2O(l)△H=﹣889.6kJ/mol.
①反应物能量总和(填“大于”、“小于”或“等于”)生成物能量总和.
②若1mol甲烷完全燃烧生成二氧化碳和水蒸气,则放出的热量 889.6kJ.(填“>”、“<”或“=”)
③已知氢气燃烧生成液态水的热化学方程式是:2H2(g)+O2(g)=2H2O(l)△H=﹣572kJ/mol,则相同质量的甲烷和氢气,完全燃烧生成液态水,放热较多的是.
④如图所示的甲池装置是由CH4、O2和KOH溶液组成的新型燃料电池,利用该装置可以将能转化为能.
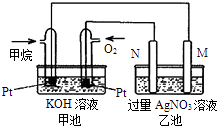
-
(2) 乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
①M电极的材料是,N的电极电极反应式为:;乙池的总反应式是,通入甲烷的铂电极上发生的电极反应式为.
②在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气为 L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的H+的浓度为.

-
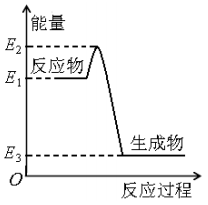
(1) 该反应是反应(填“吸热”、“放热”),该反应的△H=KJ•mol﹣1(用含E1、E2的代数式表示),1mol气体A和1mol气体B具有的总能量比1mol气体C和1mol气体D具有的总能量(填“一定高”、“一定低”、“高低不一定”).
-
(2) 若在反应体系中加入催化剂使逆反应速率增大,则E1和E2的变化是:E1,E2,△H(填“增大”、“减小”或“不变”).
-
(1) 热敷袋放出的热量来源于。
-
(2) 铁屑、碳粉、食盐、水混合后,发生化学反应的原理是。
-
(3) 写出使用热敷袋的过程中,发生的电极反应和有关的化学方程式:
负极:;
生成铁锈的反应:。
 2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2 , 达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2 , 达到平衡时放出热量a2。则下列关系正确的是( )
2SO3(g) ΔH =-197 kJ·mol-1。在25 ℃时,向恒压密闭容器中通入2 mol SO2和1 mol O2 , 达到平衡时放出热量a1;若25 ℃时,在此恒压密闭容器中只通入1 mol SO2和0.5 mol O2 , 达到平衡时放出热量a2。则下列关系正确的是( )
-
(1) 煤既可通过火力发电厂转化为电能,又可通过原电池转化为电能,通过原电池转化为电能的优点有(答两点)。
-
(2) 电工操作中规定,不能把铜线和铝线拧在一起连接线路,原因是。
-
(3) 化学电池的种类很多,依据电解质溶液的酸碱性可将化学电池分为(填数字)类,在图1所示的原电池中,其他条件不变将电解质溶液改为稀硫酸,若电流计指针偏转方向发生了改变,此时金属X可以是(填标号,下同);若电流计指针偏转方向没有发生改变,此时金属X可以是。
A.Mg B.C C.Fe D.Na
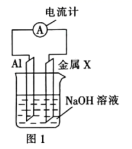
-
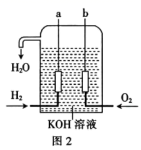
(4) 氢氧燃料电池是宇宙飞船上的一种化学电源,其结构如图2所示。两个电极均由多孔性碳制成,通入的气体从孔隙中逸出,并在电极表面放电,则a极为(填“正极”或“负极”),a极上的电极反应式为。该电池每产生1kW·h电能会生成350gH2O(l),则该电池的能量转化率为(保留四位有效数字)。[已知:2H2(g)+O2(g)=2H2O(l) △H=-571.6kJ·mol-1]
 的能量变化如图所示,则下列说法错误的是( )
的能量变化如图所示,则下列说法错误的是( )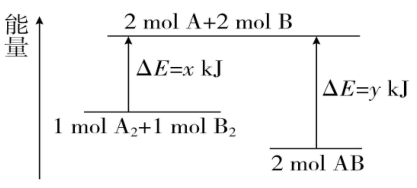
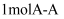 键和
键和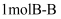 键断裂能放出
键断裂能放出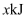 的能量
C .
的能量
C . 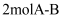 键断裂需要吸收
键断裂需要吸收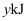 的能量
D .
的能量
D . 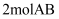 的总能量低于
的总能量低于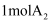 和
和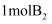 的总能量
的总能量
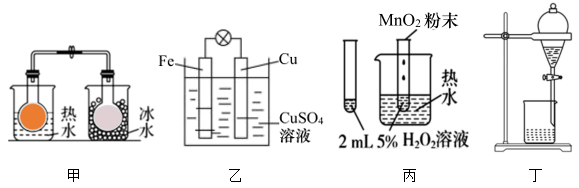
 N2O4的影响
B . 验证化学能与热能的转化
C . 验证MnO2对H2O2分解反应有催化作用
D . 从碘的四氯化碳溶液中分离出碘单质
N2O4的影响
B . 验证化学能与热能的转化
C . 验证MnO2对H2O2分解反应有催化作用
D . 从碘的四氯化碳溶液中分离出碘单质



