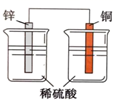
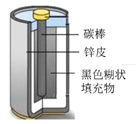
化学能与热能的相互转化 知识点题库
下列叙述错误的是( )
A . 世界是物质的,物质是在不断变化的,而物质的变化总是伴随着能量的变化
B . 人类日常利用的煤、天然气、石油等的能量,归根到底是由太阳能转变来的
C . 反应热是指反应过程中以热能的形式释放或吸收的反应物和生成物中具有的总能量的差值
D . 燃烧热是指1mol物质反应放出的热量
有关下列图象说法正确的是( )
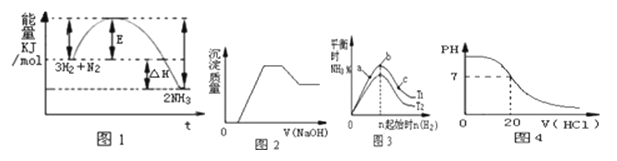
A . 由图1可知合成氨反应为自发反应,加入适当的催化剂,E和△H都减小
B . 图2表示向含有H+、Mg2+、Al3+、NH4+中加入NaOH溶液与产生沉淀质量的变化关系
C . 图3表示合成氨反应在其他条件不变的情况下,改变起始物n(H2)对此反应平衡的影响.可知反应物N2的转化率最高的是b点;T1>T2 , K2>K1(T1和T2表示温度,K1、K2表示对应温度下平衡常数)
D . 图4表示25℃时,用0.1 mol•L﹣1盐酸滴定20 mL 0.1 mol•L﹣1氨水的pH随加入盐酸体积的变化
已知1mol H2SO4(aq)与1mol Ba(OH)2(aq)反应的△H=﹣1 584.2kJ•mol﹣1;稀溶液中,H+(aq)+OH﹣(aq)═H2O(l)△H=﹣55.6kJ•mol﹣1 . 则Ba 2 + a q +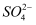 a q ═BaSO4(s)的反应热等于( )
a q ═BaSO4(s)的反应热等于( )
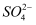 a q ═BaSO4(s)的反应热等于( )
a q ═BaSO4(s)的反应热等于( )
A . ﹣1 528.6 kJ•mol﹣1
B . ﹣1 473 kJ•mol﹣1
C . +1 473 kJ•mol﹣1
D . +1 528.6 kJ•mol﹣1
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.400℃,催化剂作用下,反应A:4HCl+O2═2Cl2+2H2O
(1)已知:
Ⅰ反应A中,4mol HCl被氧化,放出115.6kJ的热量.
Ⅱ如图,①H2O的电子式是
②反应A的热化学方程式是
③断开1mol H﹣O 键与断开 1mol H﹣Cl 键所需能量相差约为KJ,H2O中H﹣O 键比HCl中H﹣Cl键(填“强”或“弱”)
已知反应X+Y=M+N为吸热反应,对这个反应的下列说法中正确的是( )
A . X的能量一定低于M的,Y的能量一定低于N的
B . 因为该反应为吸热反应,故一定要加热反应才能进行
C . 破坏反应物中的化学键所吸收的能量小于形成生成物中化学键所放出的能量
D . X和Y的总能量一定低于M和N的总能量
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:储氢释氢NaHCO3+H2  HCOONa+H2O下列有关说法正确的是( )
HCOONa+H2O下列有关说法正确的是( )
 HCOONa+H2O下列有关说法正确的是( )
HCOONa+H2O下列有关说法正确的是( )
A . 储氢、释氢过程均无能量变化
B . NaHCO3、HCOONa均含有离子键和共价键
C . 储氢过程中,NaHCO3被氧化
D . 释氢过程中,每消耗0.1molH2O放出2.24L的H2
请根据化学反应与热能的有关知识,填写下列空白:
-
(1) 在Ba(OH)2•8H2O和NH4Cl晶体反应的实验中:反应物混合后需用玻璃棒迅速搅拌,其目的是,体现该反应为吸热反应的现象是烧杯变凉和.
-
(2) 下列过程中不一定释放能量的是 (请填编号).A . 形成化学键 B . 燃料燃烧 C . 化合反应 D . 葡萄糖在体内的氧化反应 E . 酸碱中和 F . 炸药爆炸
-
(3) 等质量的下列物质分别完全燃烧,放出热量较多的是 (填编号).A . 固体硫 B . 硫蒸气
-
(4) 已知:通常条件下,酸碱稀溶液中和生成1mol水放出的热量为中和热.稀溶液中1molH2SO4和NaOH恰好反应时放出Q kJ热量,则其中和热为 kJ/mol.
-
(5) 已知H2和O2反应放热,且断开1molH﹣H、1molO=O、1molO﹣H键需吸收的能量分别为Q1、Q2、Q3kJ,由此可以推知下列关系正确的是 (填编号).A . Q1+Q2>Q3 B . Q1+Q2>2Q3 C . 2Q1+Q2<4Q3 D . 2Q1+Q2<2Q3 .
N2(g)与H2(g)在铁催化剂表面经历如下过程生成NH3(g):
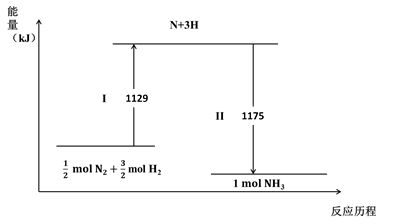
下列说法不正确的是( )
A . Ⅰ过程中破坏的均为非极性键
B . Ⅰ过程吸收能量,II过程放出能量
C . N2(g) + 3H2(g)  2NH3(g) ΔH = –44 kJ·mol-1
D . 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
2NH3(g) ΔH = –44 kJ·mol-1
D . 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
 2NH3(g) ΔH = –44 kJ·mol-1
D . 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
2NH3(g) ΔH = –44 kJ·mol-1
D . 1mol N2(g)与3 mol H2(g)所具有的总能量比2 mol NH3(g) 所具有的总能量高
下列过程能实现化学能转化为热能的是( )
A . 光合作用
B . 木炭燃烧
C . 风力发电
D . 电解饱和食盐水
下列说法错误的是( )
A . 化学反应必然伴随发生能量变化
B . 石灰石烧制石灰是吸热反应
C . 反应的活化能越大,该化学反应前后的能量变化就越大
D . 将AgNO3溶液滴加到KCl溶液中,反应的活化能几乎为零
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并己加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择( )
A . 硫酸与水
B . 氯化钠与水
C . 熟石灰与水
D . 生石灰与水
化学反应伴随着能量变化是化学反应的基本特征之一。下列说法错误的是( )
A . 右图所示的反应为放热反应  B . 化学反应中有物质变化也有能量变化
C . 需要加热的化学反应不一定是吸热反应
D . 化学键断裂吸收能量,化学键形成放出能量
B . 化学反应中有物质变化也有能量变化
C . 需要加热的化学反应不一定是吸热反应
D . 化学键断裂吸收能量,化学键形成放出能量
 B . 化学反应中有物质变化也有能量变化
C . 需要加热的化学反应不一定是吸热反应
D . 化学键断裂吸收能量,化学键形成放出能量
B . 化学反应中有物质变化也有能量变化
C . 需要加热的化学反应不一定是吸热反应
D . 化学键断裂吸收能量,化学键形成放出能量
下列说法错误的是( )
A . 化学键的断裂和形成是化学反应中能量变化的主要原因
B . 放热反应和吸热反应取决于反应物的总能量与生成物的总能量的相对大小
C . 化学反应中的能量变化,通常表现为热量的变化——放热或者吸热
D . 铁在空气中被氧化属于吸热反应
已知2H2O2(l)=2H2O(l)+O2(g)反应过程中的能量变化曲线如图所示,下列说法错误的是( )

A . 途径Ⅱ与途径Ⅰ相比,可能是加入了二氧化锰
B . 2molH2O2(l)的能量高于2molH2O(l)的能量
C . 其他条件相同,产生相同量氧气时放出的热量:途径Ⅰ大于途径Ⅱ
D . 其他条件相同,产生相同量氧气耗时:途径Ⅰ大于途径Ⅱ
下列叙述正确的是( )
A . 已知2H2(g)+O2(g)=2H2O(g) ΔH=-480.4kJ/mol ,则H2的燃烧热为ΔH=-240.2kJ/mol
B . 已知N2(g)+3H2(g)  2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C . 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D . 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C . 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D . 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
 2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C . 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D . 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
2NH3(g)ΔH=-92.0kJ/mol,则将1molN2(g))和3molH2(g)置于一密闭容器中充分反应后放出的热量小于92.0kJ
C . 已知甲烷氧化:CH4(g)+O2(g)=CO2(g) +2H2(g)ΔH=-322.0kJ/mol,则反应物的键能总和大于生成物的键能总和
D . 测量中和热的实验时,应选用的试剂为50ml 0.5mol/L的盐酸与50ml 0.5mol/L的NaOH溶液
下列依据热化学方程式得出的结论正确的是( )
A . 已知:正丁烷(g)=异丁烷(g)△H<0,则正丁烷比异丁烷稳定
B . 已知:C2H4(g)+3O2(g)=2CO2(g)+2H2O(g)△H=-1478.8k·mol-1 , 则C2H4的燃烧热△H=-1478.8kJ·mol-1
C . 已知:H+(aq)+OH-(aq)==H2O(1)△H=-57.3kJ·mol-1 , 但稀Ba(OH)2(aq)和稀H2SO4(aq)完全反应生成1molH2O(1)时,放出的热量大于57.3kJ
D . 已知:S(g)+O2(g)=SO2(g)△H1;S(s)+O2(g)=SO2(g)△H2 , 则△H1>△H2
关于化学能与电能或热能的转化,下列说法正确的是( )
| | | | |
| A.该装置能将化学能转化为电能 | B.在锌锰干电池中,电流从锌皮流出 | C.锂离子电池充电时发生氧化还原反应 | D.Ba(OH)2·8H2O与NH4Cl固体反应的能量变化如上图所示 |
A . A
B . B
C . C
D . D
部分含铜物质的分类与相应化合价关系如图所示。下列推断不合理的是( )
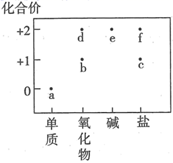
A . a可与某些酸反应生成f
B . c既可被氧化,也可被还原
C . d可通过一步反应直接转化为e
D . e可通过一步反应直接转化为b
通过以下反应均可制备 :
:
 :
:①煤炭与水反应制氢:
②甲烷与水反应制氢:
③太阳光催化分解水制氢:
下列有关说法正确的是( )
A . 通过反应①可以将煤转化为清洁燃料
B . 若反应②使用催化剂,则 减小
C . 反应③在低温下可以自发进行
D . 制备等物质的量的
减小
C . 反应③在低温下可以自发进行
D . 制备等物质的量的 需要吸收的能量:①<②<③
需要吸收的能量:①<②<③
 减小
C . 反应③在低温下可以自发进行
D . 制备等物质的量的
减小
C . 反应③在低温下可以自发进行
D . 制备等物质的量的 需要吸收的能量:①<②<③
需要吸收的能量:①<②<③
根据图信息,下列叙述正确的是( )

A .  跟
跟 反应生成
反应生成 (气态水)吸收能量为490
(气态水)吸收能量为490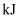 B .
B .  的能量比
的能量比 与
与 的能量之和低
C .
的能量之和低
C .  跟
跟 反应生成
反应生成 (液态水)释放能量为245
(液态水)释放能量为245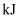 D . 化学反应中能量变化的大小与反应物的质量多少无关
D . 化学反应中能量变化的大小与反应物的质量多少无关
 跟
跟 反应生成
反应生成 (气态水)吸收能量为490
(气态水)吸收能量为490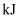 B .
B .  的能量比
的能量比 与
与 的能量之和低
C .
的能量之和低
C .  跟
跟 反应生成
反应生成 (液态水)释放能量为245
(液态水)释放能量为245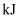 D . 化学反应中能量变化的大小与反应物的质量多少无关
D . 化学反应中能量变化的大小与反应物的质量多少无关
最近更新